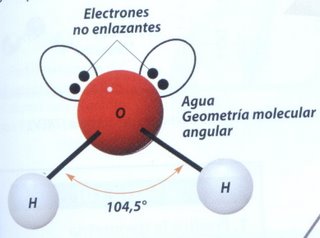
- La molécula de agua H2O posee dos enlaces simples O - H y yiene dos pares de electrones no enlazantes en el átomo de oxígeno. Su geometría molecular es angular.
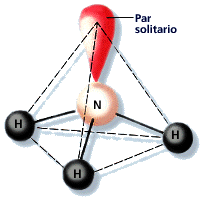
- La molécula de amoníaco (NH3) presenta 3 enlaces simples N - H y posee un par de electrones no enlazantes en el nitrógeno. La geometría molecular es piramidal.
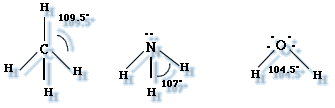
- La molécula de metano (CH4) tiene cuatro enlaces simples C - H y ningún part de electrones enlazantes. Su geometría molecular es tetraédrica.
¿Cómo se puede saber la geometría de una molécula?
En la actualidad se emplean diversos métodos experimentales para conocer en forma precisa la estructura de una molécula particular. Pero en ocasiones basta con aplicar algunos métodos sencillos para obtener una geometría molecular aproximada.
Uno de los métodos para predecir la geometría molecular aproximada, está basada en la repuslsión electrónica de la órbita atómica más externa, es decir, los pares de electrones de valencia alrededor de un átomo central se separan a la mayor distancia posible para minimizar las fuerzas de repulsión. Estas repulsiones determinan el arreglo de los orbitales, y estos, a su vez, determinan la geometría molecular, que puede ser lineal, trigonal, tetraédrica, angular y pirámide trigonal.
Geometría lineal: Dos pares de electrones alrededor de un átomo centarl, localizados en lados opuestos y separdos por un ángulo de 180º.
Geometría planar trigonal: Tres pares de electrones en torno a un átomo central, separados por un ángulo de 120º.
Geometría tetraédrica: Cuatro pares de electrones alrededor de un átomo central, ubicados con una separación máxima equivalente a un ángulo de 109,5º.
Geometría pirámide trigonal: Cuatro pares de electrones en torno a un átomo centra, uno de ellos no compartido, que se encuentran separados por un ángulo de 107º.
Geometría angular: Cuatro pares de electrones alrededor de un átomo central, con dos de ellos no compartidos, que se distancian en un ángulo de 104,5º.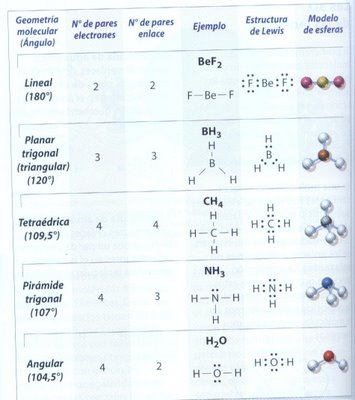
Al leer todas estas descripciones, vemos que la forma de las moléculas es el resultado de las direcciones en que se ubican los electrones enlazantes. Parece increíble pensar que la forma que tiene una molécula es determinante en la manera como actúa, estableciendo sus propiedades.



muy buen blog...profe...
ResponderBorrarme ha servido demasiado
demasiiiado bueno esto realmente un apoyo !! =)
ResponderBorrarhola!
ResponderBorrarme ha ayudado mucho su pagina!
hoy tengo pruba de nivel e quimica y me entra arta materia de aqui!
esta muy claro y facil de aprender!
bueno gracias! =D
espero q me vaia bm en la prueba! ^^
Hola profe pos creo q su blog esta buenisimo soy un pelao de Colombia a quien a seguido este blog y creo q me fue muy util gracias profe
ResponderBorrarhola, soy karen.
ResponderBorrarprimera vez que visito esta página y me parece genial!!!
esto de la educación chilena de rendir una prueba para ingresar a la educación superior...
pero lo bueno es que existe la forma de sacar 850 puntos..
y esta página se ue me ayudará.
muchas gracias!!!
:-)
ReAlMeNtE Me hA AyUdADO bAsTaNtE sU PagInA, Lo feLiCiTo!!!! pErO AuN SiGo coN Un PrObLemA aTrAVeZaDo.
ResponderBorrarpArA uN TRaBaJo nEcEsItO hAcEr UNA mAqUeTa dEl "METILPROPANO/ISOBUTANO" pErO POR mas k He buScAdO Y hE TraTaDo Yo miSmA De HaCeR cAlCuLoS No LoGrO cOnSEguIr La aMpLiTUD De SuS AnGUlos! LE AgRaDeCerIa mE pUdiErA OrIeNtAR...
dE AnTeMaNo gRaCiAs!!
PD. eSpErO PuEdA LeEr sTo PrOnTo!!
Por favor. Te ayudaría si primero escribieras correctamente
Borrarhola me llamo sonia muxas gracias
ResponderBorraresta super claroo todo :D
suerte en too
bye bye
tuve que realizar un trabajo sobre geometria molecular...y este blog me a resultado muy util...muchas gracias!!!!!!!!
ResponderBorrarposta... buenisima la pag. grax!!!!!!
ResponderBorrarGracias
BorrarBueno, de antemano saludarlo y felicitarlo.
ResponderBorrarSoy universitario; sin embargo, el material que cargo Ud. me ha servido de mucho.....
Saludos....
La verdad es que estoy en cuarto medio y nos están repasando toda la materia de los años anteriores. Este lunes tengo un ensayo de Química y estoy repasando toda la materia, desde atómos a estequimetria...de verdad, hacen falta más blogs como este. Me ha sido de mucha ayuda.
ResponderBorrarSaludos
Javiera
=O!!!!
ResponderBorraresta muy bueno!!!!
gracias por el gran aporte! :)
Saludos desde la IV regien xD
soy una xica de parral y queria decirle k su trabajo me a ayudado muxo y queria darle las gracias...
ResponderBorrarfelicitaciones...
18-06-07
claudita
olaa!!!
ResponderBorrarbuen log, me ayudo mucho
la verdad no le entendia a mi profesor y decidi buscar en internet..y me encontre con su pagina..
me gustaria que pusiera informacion sobre
geometris angular, tetraedrica lineal..etc.. por me me mandaron a hacer un trabajo donde las debo contruir y la verdad no se como acerlo.. por que hay ke sacar la configuracion electronica ya algo si
ojala pueda ayudarme
bno mxas gracias y le dejo mi mail por si se kiere comunicar conmigo
shivy_89@hotmail.com
gracias por la ayuda, clarifica mucho todas las dudas, es una manera simple pero sustanciosa de aprender
ResponderBorrarolaaaaaaaaaaaaaaa
ResponderBorrarcreo q la quimica es muy complicada
ademas de una lata......
me aburro tanto en las clases de quimica q me da hasta sueño...
pero igual grande por usted q se atreve a hacer un blog con este
tema tan fomeee......
xauuuuu
LO FELICITO, SU INFORMACION ME AYUDO MUCHISIMO. GRACIAS
ResponderBorrarwena pos conxatumadre
ResponderBorrarprofesor reculiao no sabi ni contar
y te tay haciendo flogs de kimika wn
te gusta anal, y la del burro te la comis entera
Hoy tengo clase con algunos alumnos y me ha servido muchísimo la didáctica, la manera simple de la explicación, mis alumnos y yo le estamos agradecidos , gracias.
ResponderBorrarJunior.
Esta chevere!
ResponderBorrarmike-colombia
MUCHAS GRACIAS!!!! ME DIO UNA SALVADA!!!! LA VERDAD TENIA PROBLEMAS PARA ENCONTRAR INFORMACION CON IMAGENES, Y AHORA QUE ESTOY ESTUDIANDO BUIOIQUIMICA ERA MAS DIFICIL, BUENO, EN RESUMEN GRACIAS!!!!
ResponderBorrarsoi camila y creo que es muy bueno este blog ademas que me sirvio muchisimo!!=) gracias!!..
ResponderBorrarhola soy su papai y esta chido esto
ResponderBorrarvale,profe,nos hizo la tarea,idolo,delfin hasta el fin
ResponderBorrarhola profe super bueno
ResponderBorrarhttp//rebeliondeltexto.blogspot.com
ResponderBorrarGracias profe, que bacan que no hayan lucros para difundir enseñanza, muy valorable,;)
Hola mi nombre es María Ignacia.
ResponderBorrarQuería agradecer por la claridad al entregarme estos contenidos. Me ha sido muy útil llegar hasta aquí ya que mañana realizaré una prueba de olimpiada de química, y la verdad estaba algo débil en esto. Por lo mismo, muchísimas gracias.
esta genial tu pagina aunque le falta un pogo de ejercicos es una sugerencia
ResponderBorrarquisera saber lo siguientee lo antes posible.......si la molecula PF3 tiene forma de piramide de base mientras qu la molcula BF3 es triangular.explicar por qué las formas de estas moleculas
ResponderBorrarbuenisimo.... ayuda bastante
ResponderBorrarexcelente blog! gracias...
ResponderBorrarla verdad el blog esta genial y te ayuda en mucho, gracias por resolver mis dudas, y siga poniendo tan buena informacion
ResponderBorrarta weno
ResponderBorrargracias por los cuadros de geometria molecular (:
ResponderBorrarHola soy Estefania...
ResponderBorrarEsta muy bien explicado y las gráficas ayudan un montón.
Quería informar q hay un error de gramática en el texto, en la palabra "claro"...
Hola soy Estefania...
ResponderBorrarEsta muy bien explicado y las gráficas ayudan un montón.
Quería informar q hay un errores de gramática en el texto...
Muchas gracias por el blog, me sirvió de mucho
[b]ULLLUIIIIIIIIIIIIIII!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!![/b]
ResponderBorrarchewacca seekoooooo
ResponderBorrarCLAN CAMPO ESTUVO AKI
ResponderBorrar------------
;>!
ULLUIIIIOA
jose gay
ResponderBorrarchemy mas gay
fer gay tambien
la sca tambien xd
SEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEKKKKKKKKKKKKKKKKKOOOOOOOOOOOOO!!!!!!!!!!!!!!! CHEWBACA SAYS :PONTIFICE SANTA MAMADA SUPREMA KAYOSAMA
ResponderBorraratt: Karlita
ResponderBorrarEsta super chida su pag me agrada... bueno al menos nos ayuda un buen jeje
hola es la primera ves que visito esta pagina y me ha parecido muy buena y quisiera saber si me podrian ayudar con la geometria molecular del ion IF4 con una carga negativa.... muchas gracias
ResponderBorrarEL KATI MUY MAXOOOOOOOOOO!
ResponderBorrarhola soy julian quiroga , me encanta tu pagina me parece interesante e importante tu ayuda.Tu pagina me ha ayudado a comprender claramente cada tema espero seguir contando con tu ayuda.
ResponderBorrarmuchas gracias por todo
JULIAN QUIROGA
Hola! quiero agradecerles por haber hecho esta pagina porque estaba decesperada no entendia nada de quimica y menos este tema, la verdad me salvaron la vida. Muy bueno.Luisa
ResponderBorrarhola! esta muy claro este tema los felicito por el blog esta muy facil de entender espero salir bien en mi prueba..:)
ResponderBorrarmuy bueno profe pero no me quedo claro lo que buscaba ¿cómo se cuando va hacia adelante o hacia atras los atomos perifericos?
ResponderBorrarbueno siga asi
si me lo puede explicar mejor
lorena201291@hotmail.com
gracias!!!!!!!!!!
Toos los wns del luf son unas mierdas exepto los cursos de seleccion, - el diego y el ariel q c komen.
ResponderBorrarhhjoaoajo la wea aweona...
ResponderBorrarel diego terminó con el ariel saco e wea
eri terrible e pollo coto ql xD
p.d: el Oni la lleva y wea ^_^!
bueno me gusto es ta pagina y felicidades espero que tenga exitos esta pagina bay :D
ResponderBorrarMe ayudaria mucho saber mas informacion sobre la tetraedrica, ocupo hacer una exposicion sobre ella y todavia no tengo mucha informacion cualquier ayuda me serviria de mucho gracias!!
ResponderBorrarke dislexica la persona ke hizo el blog pero iwaal me sirvio la pagina
ResponderBorrarta xvre su explicacion pero deseria saber si se podria dar una hibridacion sp3d3 y que forma espacial tendria.. si lo pudiera conseguir profe mandeme la informacion a este correo arturo_1110_15@hotmail.com gracias xD!
ResponderBorrarExcelente ! me encanto tu blog, tiene mucha informacion buena =)
ResponderBorraradioz!
la verdad q la pagina m parecio una garcha y tmb queria decir q m paso por el quinto forro d las pelotas lo q dicen todos estos putos del orto!!! CUERVO PUTO Y VIGILANTE! AGUANTE RIVER!
ResponderBorrarmuchas gracias! posta q no encontraba en ningun lugar esto que buscaba me vino barbaro! gracias..
ResponderBorrarbesoo :)
dema chida bn prof
ResponderBorrarmetale mas como enlces covalentes, iónicos y metálicos
esta chida la pagina pero deberian agregar más infrormacion sobre la hibridacion y otras formas geometricas
ResponderBorrarHola, soy estudiante de 1º de carrera en la escuela de ingeniería de Álava(en Euskadi,España). Estudio ingeniería técnica industrial(especialidad en mecánica), y la verdad es que tenemos un nivel de química bastante flojo en esta carrera. Su página me ha servido para comprender la geometría de las moléculas, felicitaciones, y gracias por molestarse en crear la página, seguro que a muchos estudiantes les sirve de utilidad. Adiós y buena suerte.
ResponderBorrarHOLA SOY ANGELICA , LA verdad es que la pagina es buenisima la unica queja es su falta de ortografia solo eso y grasias por todo
ResponderBorrarla verdad no m dio la sufisien te infor macion k estoy buscando pero de algo me servira!!!!
ResponderBorrarbueno eso espero x k mi profe es bien estricta y eso k boy en secu
bueno me parec q la quimica no es complicada solo es cuestion de que la practiquemos y haci veras que no estan complicada cm le parecn a algunos... y bue gracias a los inventores de esta pagina ya que cn la misma he salido muy bien en clases... esto es un milagro :) ;) ...chiripa
ResponderBorrarOLAZZZZZZZ JAJA GRACIAS ME SALVE DE LA TAREA DE QUIMICA 100 GRAX XAU SALU2 SE CUIDA Q STE BN
ResponderBorrarMe sirvió demasiado para una tarea, Saludos desde México!
ResponderBorrarbuenasshh la verdad esh que eshto a shido de gran utilidad ya que mañana tengo una evaluation de chemitry y me fue dr gran utilidad
ResponderBorrarxoxo gossip girl
esto esta genial!!!
ResponderBorrar:)
juli
que putas!!!, haber si me respondes este problema: cuando es la electronegatividad de todos los elementos al mismo tiempo, tu pagina culera no me ha servido de nada y si borras mi comentario esres un marik gripollas.
ResponderBorrarDe verdad, que átomo se considerará central cuando todos los átomos que conforman una molécula tienen la misma electronegatividad?
ResponderBorrargracias a esto voy a pasar a segundo de prepa muchas gracias
ResponderBorrarque wea mas chanta su blog se nota que copian todo de otras paginas.
ResponderBorrarMa ensimas lo weones flojo que buscan aqui latareas son todos uno putos de mierda
En primer lugar: quiero darle las gracias por el exelente tratabajo que nos dirige y a la vez felicitarle.
ResponderBorrarEn segundo: La informacion es muy completa.Pues, me sirvio mucho para una tarea.
Gracias.
Att.:Leslie Rebatta
edad:13 años.
grado: 3º de secundaria.
Ucayali - Pucallpa - Perú
profe esta muy bueno tu blog te felicito, me ha servido de mucha ayuda en el colegio.
ResponderBorrarGracias compadre me sirvio caleta sigue asi jajja :)
ResponderBorrarwena profe tanto tiempo muy bueno su blog.... cuidece mucho
ResponderBorrarOyee de verdad, muchisimas gracias. Me salvaste (:
ResponderBorrarno se de que se quejan esas otras gentes, me parece que ha stado util entrar aca, me aclaro muchas dudas q tenia
ResponderBorrarmuchas gracias ;)
saludos desde costa rica
Hola quisiera ayuda para química y creo aquí la puedo encontrar pero no se como buscar alguien me puede ayudar
ResponderBorrarola el blog esta bien pero le falta mas puntos y separacion de subtemas como las diferencias para reconocer entre geometria molecular y electronica se q puede mejorar. Arriba Perú.
ResponderBorrarputa ESTO NO ME SIRVE PUTA
ResponderBorrarmuchas graciiias =D .. esta buenisimoo .. mañana tengo prueba de esto y me flta materia y todo esto esta bien resumido y muy facil de enender .. ahora puedo comprender mucho mas los ejercicios gracias!! .. bendiciones :D
ResponderBorrargracias por el aporte :)
ResponderBorrarmuy bueno
quien dice ke la quimica es fome no sabe lo que habla... yo pase a tercero medio y m encanta la ciencia sobre todo quimica y fisica y no tienen nada de aburrido me gusta mucho grasias x la info :) m aclaro muchas cosas n_n
ResponderBorrarmuuy buen trabajo los explica bien sin tantas palabras rebuscadas
ResponderBorrarpor fin entendi esta materia!!!!!!! lo felicito señor jeje me ha solucionado un gran dolor de cabeza GRACIAS
ResponderBorraresta super vueno, esta todo lo que nesecito saver para poder acer mi gia aora grasias.
ResponderBorrarbuenisimo =)
ResponderBorraratte boxin =)
Falta angular plana...., pero igual me ayudo mucho
ResponderBorrarxd
Demasado bien explicado.. Gracias!! me ayudo mucho!
ResponderBorrarMUY BUENO EL MATERIAL.ME HA SERVIDO MUCHÍSIMO.GRACIAS
ResponderBorrarHola
ResponderBorrarque les chupen el culito a todos y a keren le ronpan el culo.
ResponderBorraresta de huevos"!!!!
ResponderBorraryeahhh!!!! graxias chaooo"!!!!
esta de huevos"!!!
ResponderBorraryeahhh"!!! graxias chaooo"!!!
es una muy beuna pagina, mañana rindo examen y me quede con la duda y ahora me la saque, m bien ilustrado y dados lo ejemplos
ResponderBorrarmuchas gracias
Muchas gracias me ha servido de mucho yo estaba haciendo el CF4 y el NH3 ;)
ResponderBorrarSaludos!
Exelente gracias por el aporte
ResponderBorrargracias me dejo en claro muchas cosas qe el 1º año en enseñanza media no me lo dejo ya qe no ponía atencion en la clase jajajaja muchas gracias
ResponderBorrarhola:
ResponderBorrarmuchisimas grax por el blog es muy claro y entendible ademas de lo resumido que esta
muy bueno!
ResponderBorrarGracias! Me sirvio mucho :)
ResponderBorrarquer puteria es esto no sirve para nimadres wac
ResponderBorrarmuy buen blog como estos que este lleno el internet
ResponderBorrarDe verdad que bueno su trabajo. Gracias!!!
ResponderBorrarMuy buno es blog. Me ayudo muchisimo.
ResponderBorrarAtt.: Miku Hatsune ^^
hola muchas graciias esta pagina me sirvio un monton..nuevamente graciias
ResponderBorrarMUy bueno, lo felicito
ResponderBorrarCÑOR MUII BN X SU TRABAJJO X FIN PUD COMPRENDR UN POK STA MATERIA PERO ALGO S ALGO.... MUCH TNKIU VERY GADX
ResponderBorrarGracias profe!! aunque no sé quién es le agradezco mucho por las entradas que publica en su blog, me han ayudado mucho,ya que estamos en clase de química y tenemos que investigar sobre la Geometría molecular en algunos compuestos. Adiós!!
ResponderBorrarPor si a alguien le interesa, he encontrado esto por ahí. Es una tienda que venden camisetas de moleculas....
ResponderBorrarhttp:www.camizetas.net
Un saludo a todos y buen blog.
que increible... diciendo que la ortografía esta mala.. y al final pone graSias oooseeeaaaa UBÍQUESE se escribe con C...!!
ResponderBorraremm bueno esta materia me ayudo xq mañana tengo prueba de esto super la paginaa
ResponderBorrarhola profe..soy jairo...curso 1 medio en el colegio creacion de concepcion,chile...kiero decirle que su pagina es mui wena,, me ayuda mucho con la materia...mañana tengo prueba de esto espero ke me vaya bien adiossss....1 de septiembre del 2011
ResponderBorrargracias, me ha servido bastante saludos :D
ResponderBorraresta muy bien todo gracias¡¡
ResponderBorrarestudio en la uni (
ResponderBorrarPerú) aun siendo universitaria me a ayudado mucho profesor me resultado genial no pensé encontrar tan rápido respuesta , me ah sido muy útil (demasiado bueno)
muchas gracias...
la explicación esta bien pero creo q mejor se tienen que basar en ángulos como 109 180 120 como menor o mayor a esos ángulos ......
ResponderBorrarMuchisimas gracias me vino r ebien y a unos compañeros tambien. Estudiante de Junin Argentina, saludos y gracias!
ResponderBorrarGracias me ayudo mucho esta pagina ojalas me valla bien en la prueba :L
ResponderBorrarmi nombre es luis roberto y sabe es un orgullo que personas como usted den un bune uso a la computadora...que sirva de mejor conocimiento.
ResponderBorrarHoy me encontraba investigando los tipos de geometria, en cuanto vi esta pag. me gusto mucho bueno que este de lo mejor y siga contaminandonos de CONOCIMIENTO
no me gusto la informacion es muy mala!!! :(
ResponderBorrarhuelen a ovo
ResponderBorrarBuena LA Informacion .. Pero Faltan Algunos Datos (:
ResponderBorrarGracias gracias gracias!!!!
ResponderBorrarpara el amigo que pregunta sobre el PF3 y el BF3,el PF3 es piramidal debido a que el fosforo (P) tiene 5 electrones de valencia y 3 están formando enlaces con el fluor por lo que le queda un par libre,ocurre lo mismo con el NH3, por lo que las moleculas que forman 3 enlaces simples y tienen un par libre piramidal, el boro tiene 3 electrones de valencia y los 3 estan formando enlace con el fluor por lo que no es piramidal sino trigonal plana debido a que forma 3 enlaces simple y no tiene electrones libre, fijate que es igual al BH3 espero te sirva la información saludos
ResponderBorrarPROFE k buen blog tiene...esta super padre todo xk; esta muy especificado y se entiende..GRACIAS bye:)
ResponderBorrarexcelente!!!! muchas gracias :D
ResponderBorrardisculpe pero me podria aclarar una consulta ¿que tipos de oerbiatles hibridos se forman en el metano?
ResponderBorrarcuando realizo la geometria triangular plana, en un superficie plana queda Acostada o parada?
ResponderBorrarhola; por favor me podiran ayudar a resolver este ejercicio?
ResponderBorrara 20°C, 1.26*10^24 moleculas de una sustancia liquida cuya formula es
C6 H4 Br2 ocupan un volumen de 0.253 dm^3.
CALCULAR el volumen molar del liquido a esa temperatura, expresado en cm^3/mol.
CALCULAR el numero de atomos de carbono contenidos en 5.50 mol de la sustancia.
ESPERO SU RESPUESTA DESDE YA MUCHISIMAS GARCIAS
Geniaaaal me re sirvio lo de la geometria, no lo entendia hasta hoy viendo esto. Gracias gracias gracias!
ResponderBorrares la primera vez que entro a esta pagina pero es de mucha utilidad de verdad ens de mucha utilidad
ResponderBorrarHola , muchas gracias por haberme ayudado a estudiar tengo prueba de la Geometría Molecular y esta pagina me ayudó mucho a comprender el contenido hasta se lo recomendé a una amiga :)
ResponderBorrarmmm no entendi nada no me sirvio la verdad :/
ResponderBorrarwww.facebook.com/tacticasextremas
ResponderBorrarme ayudan con un mg porfavor? porfavor! :(
OE ERMANO NOSE PUBLICAH LA WEA, TOY TERRIBLE ENCHUCHAO CON ESTA WEA ELMANO QUERIA DECIRLE Q VENDO MOTA A 10 LUKITAH
ResponderBorrarVIVA PINOCHET CTM
ResponderBorrarDAME UN 20 HERMANO
ResponderBorrarAnónimo ELQUIMICOBNREADYPAVOH
ResponderBorrarMIRA QUIMIICO QLO SOBATE LAS GOMAS
NO TE METAI CON EL ELQUIMICOBNREADYPAVOH, ESE LOCO ME PASA LOS WIROS COMPARE
ResponderBorrarmuchas gracias
ResponderBorrarGreat...
ResponderBorrarMuy buen blog
ResponderBorrarque bueno que esta pagina me ayudo
ResponderBorrarmuy bien, me gusta
ResponderBorrarhttp://sonla.tw
disculpe como puedo calcular el angulo sin las predicciones ya establecidas
ResponderBorrardisculpe pero ahi alguna otra manera de saber como una molecula puede tener diferente geometria molecular, aparte de la teoria de repulsión de pares de electron de la capa de valencia (TRPECV)
ResponderBorrarConfiguracion electronica de nh3???
ResponderBorrarConfiguracion electronica de nh3???
ResponderBorrarMuy buena expliacion
ResponderBorrarEstá super claro, me ayudóbastante a entender y responder mis dudas, muchas gracias por su disposición para compartir sus conocimientos
ResponderBorrarsobres esta muy bien gracias
ResponderBorrarme sirvió mucho gracias profesor :)
ResponderBorrar
ResponderBorrarThanks a ton for sharing this awesome web-site. https://shop4shoe.com
Genial esta materia!!!!
ResponderBorrarmuy bien
ResponderBorrar