
- El átomo es la mínima porción de materia que no puede dividirse por ningún proceso conocido.
- Los átomos de un mismo elemento son iguales tanto en masa, tamaño como en sus demás propiedades.
- Los átomos de elementos diferentes son también diferentes en todas sus propiedades.
- Los átomos se combinan entre sí en relaciones enteras sencillas para formar compuestos.
Actualmente:
- El primer postulado ya no se ajusta a la realidad por el descubrimiento de las partículas subatómicas: electrón, protón y neutrón.
- El 2º y 3º postulado ya no se cumple con el descubrimiento de los isótopos e isóbaros respectivamente.
- El 4º postulado se cumple hoy. Por ejemplo, el agua se forma por la combinación de 2 átomos de H y un átomo de O, quedando la relación entre ellos como: H2O
2. Modelo Atómico de Thomson (1898): Representa al átomo como una especie de esfera homogénea de electricidad positiva, en donde se encuentran distribuidos los electrones, atraídos electrostáticamente, en número suficiente para que el conjunto resultara neutro. Su modelo atómico lo asemeja a un budín de pasas.

El átomo que representa éste modelo es un átomo estacionario por la inmovilidad que presentan los electrones. 
Powered by Castpost
3. Modelo Atómico de Rutherford (1911): Basado en el descubrimiento del núcleo atómico, Rutherford establece un modelo para el átomo de hidrógeno.

Donde:
El átomo está constituido por un núcleo central que es la región donde se encuentran las cargas positivas, y alrededor se encuentra el electrón.
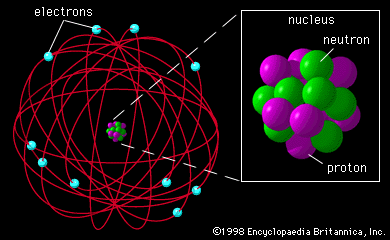
- El electrón se encuentra girando alrededor de del núcleo; describiendo órbitas circulares de forma similar a los planetas que giran alrededor del sol; denominándose Sistema planetario en miniatura.
- La fuerza centrífuga que desarrolla al girar el electrón, contrarresta la fuerza de atracción electrostática que ejerce el núcleo (+) sobre el electrón (-).
- El diámetro del átomo es aproximadamente unas 10000 veces mayor que el diámetro del núcleo. Por lo tanto, el átomo es prácticamente hueco, al poseer espacios interatómicos.
Pincha aquí para ver la simulación del modelo de Rutherford
Error de Rutherford: Según la física clásica un cuerpo cargado eléctricamente al estar en movimiento este emite energía; por lo tanto, el electrón perderá energía y caería hacia el núcleo con una trayectoria de espiral, lo que no sucede con la experiencia.La solución a este problema la dió en 1913 Niels Bohr basándose en la teoría Cuántica de la radiación electromagnética, dada a conocer por Max Planck.
4. Modelo Atómico de Niels Bohr:

En 1913 Niels Bohr discípulo de Rutherford propone un nuevo modelo para el átomo de Hidrógeno aplicando acertadamente la teoría Cuántica de la radiación de Planck. Su modelo está basado en los siguientes postulados:
- El átomo de hidrógeno consta de un núcleo (+) y a su alrededor gira en forma circular un electrón (-), de tal manera que la fuerza centrífuga contrarreste la fuerza de atracción electrostática.
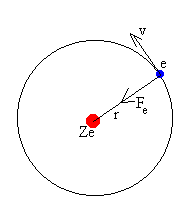
- El electrón sólo gira en determinadas órbitas de radios definidos, llamados también niveles cuantificados de energía.

- Mientras los electrones permanezcan en un mismo nivel de energía (llamados estados estacionarios por Bohr) no ganan ni pierden energía.
- Un electrón puede cambiar de un nivel a otro dentro de un mismo átomo ganando o perdiendo una cantidad de energía igual a la diferencia existente entre ambos estados. De este modo, todo cambio energético del electrón corresponderá a saltos que haga entre los estados estacionarios.
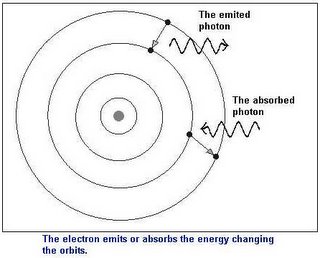
- Un átomo sólo emite energía cuando un electrón salta de un nivel de energía superior a otro inferior y absorbe energía en caso contrario. La energía emitida o absorbida por el átomo recibe el nombre de fotón o cuanto de luz.


La línea roja en el espectro atómico es causada por el salto del electrón de la tercera a la segunda órbita
 La línea verde azulada en el espectro atómico es causada por electrones saltando de la cuarta a la segunda órbita.
La línea verde azulada en el espectro atómico es causada por electrones saltando de la cuarta a la segunda órbita. 
 La línea azul en el espectro atómico es causada por electrones saltando de la quinta a la segunda órbita.
La línea azul en el espectro atómico es causada por electrones saltando de la quinta a la segunda órbita.
 La línea violeta en el espectro atómico es causada por electrones saltando de la sexta a la segunda órbita.
La línea violeta en el espectro atómico es causada por electrones saltando de la sexta a la segunda órbita.
Pincha aquí para ver la animación del modelo de Bohr
Observaciones:
Niels Bohr llegó a establecer una ecuación que permitió calcular la energía potencial de cada nivel energético del átomo de hidrógeno, tomando en cuenta factores como la masa y la carga eléctrica del electrón. En dicha ecuación se representa al nivel de energía mediante una letra “n” a la que se le da el nombre de número cuántico principal y que distingue a los niveles de energía. Así, a cada uno de los diferentes niveles de energía le corresponderá un determinado valor “n”. Estos valores son números enteros (1, 2, 3, 4, etc). Los átomos de los elementos más grandes que se conocen actualmente tienen un máximo de 7 niveles y, por ello, el valor máximo de “n” para esos es 7.
Bohr relaciona, así, los estados estacionarios 1, 2, 3, 4, etc., con las llamadas capas electrónicas K, L, M, N, O, P y Q, y estableció que el número máximo de electrones de una órbita o nivel de energía “n” era igual a 2n2.
Niels Bohr logró explicar, gracias a su modelo, las líneas espectrales del átomo de H; con el tiempo su teoría sufrió muchas modificaciones, pero le cabe el mérito de haber orientado las investigaciones posteriores al fundar la mecánica cuántica.
Nota: Las líneas espectrales del átomo de hidrógeno son las transiciones o saltos de los electrones de uno a otro nivel de energía. Estas emisiones u absorciones de energía pueden captarse en los llamados espectros.
- Espectro de líneas de emisión: Son líneas brillantes de diferentes colores que se emiten cuando se produce una carga eléctrica sobre el hidrógeno.
- Espectro de líneas de absorción: Son líneas oscuras que se originan cuando se hace incidir la luz blanca sobre el hidrógeno gaseoso.
Restricciones del modelo de Bohr:
- No puede explicar los espectros observados para átomos multielectrónicos (más de un electrón).
- Sólo es aplicable para átomos monoelectrónicos (un solo electrón) como el hidrógeno.
Powered by Castpost
5. Modelo Mecano Cuántico (actual): A partir de 1925 el modelo atómico de Bohr fue objeto de sucesivas modificaciones hasta formular el actual modelo atómico, que es un modelo matemático que explica el comportamiento del electrón en átomos que tienen más de un electrón.
Este modelo esta basado en los siguientes principios:
- En 1924 Louis de Broglie (Premio Nobel 1921) propuso que el electrón tendría propiedades ondulatorias y de partícula (al igual que la energía lumínica).
- En 1926 Werner Heisenberg (1901-1976) formula el Principio de Incertidumbre, el cual establece que es imposible determinar simultáneamente la posición y la velocidad exacta de un electrón.
- En 1927 Erwin Schrodinger (1887-1961) propone una ecuación matemática que da al electrón el carácter de onda y de partícula simultáneamente, ya que incluye la masa del electrón y una expresión que puede considerarse la amplitud de la onda de dicha partícula. La ecuación de Schrodinger da la posición más probable del electrón en un átomo de hidrógeno, pero también establece que se le puede encontrar en otras posiciones. En la actualidad se emplean cálculos probabilísticas para describir la posición, la velocidad y la energía de los electrones en el átomo.
El modelo atómico vigente, establece que en el átomo existen unas zonas delimitadas donde hay una mayor probabilidad de encontrar al electrón; a esta zona se le llama "orbital". Por lo tanto, según este modelo, el electrón no se circunscribe a una órbita fija, sino a una zona llamada orbital dentro de la cual existe una alta probabilidad de encontrar al electrón.
Estos orbitales se agrupan, a su vez, en los distintos niveles de energía.
Niveles y subniveles de energía:
Al perfeccionarse la espectroscopia se pudo observar que las líneas espectrales estaban constituidas por varias rayas más finas agrupadas. Si las líneas gruesas representan la emisión hecha por los electrones al ingresar a un determinado nivel proveniente de otro de mayor energía, las rayas finas que las integran representan saltos de electrones dentro de un mismo nivel principal. Existen entonces, subniveles de energía a los que se les asigna un número cuántico secundario (l).
Pincha aquí para ver el resumen de los modelos atómicos

148 comentarios
muy bueno, nos sirvio bastante.. peeero nos falto mas informacion para los niveles y subniveles energeticos.
hola
muchas gracias por publicar este articulo me fue de mucha ayuda con los niveles electronicos por fecha :)
saludos desde México
ah perdon me confundi eran los modelos atomicos igual gracias
gracias por publicar esta informacion, es una forma de ayudar a los estudiantes actuales
me parece que es mucho no me gusto
por que ahora tengo que copiar todo
Gracias , fue de gran ayuda espero que sigan aportando la misma informacion para otros temas
NO ENTIENDO ALGUNA INFORMACION POR QUE EN UNAS PAGINAS DE INTERNET BIENEN DIFERENTES MODELOS ATOMICOS.
POR FAVOR PONGANSE DE ACUEDO.
LA VERDAD ES QUE ESTE BLOG ESTA MUY BUUUUEEENOOO,YA QE ESTA TODO MUY BIEN EXPLICADO LO QUE ASE QUE SEA MMÁS FACIL DE ENTENDER...
GRACIAS UN ABRZO, SALUDOS CHILE!!
HOla!! muchísimas gracias por la ayuda..!! me sirvió muchooo la informacion..!! =D
gracias chavos sigan estudiando para que me pasen la tarea
material muy bueno ,entendible y bien explicado,solo ke porfa un poco mas de informacion porke pienso ke hay mucha mas informacion acerca del tema.por eso les digo ke sigan asi ,para ke todos podamos entender cosas complicadas de una manera sensilla.
un saludo
gracias...
me sirve mucho esta informacio
aparte esta
muy completa...!!!
gracias por su informacion m ayudo mucho para un trabajo gracias saludos
Moises dijo...
que loco sta me sirbiò de mucho q bien estan formado los modelos de dalton
Que buen blog...me servirá para sacar algunas ideas ahora que tendré que hacer clases de modelos atómicos...
Buen blog, pero yo definitivamente odio esta materia, y tengo que hacer un mapa conceptual gigante de toda la materia. Odio a mi profesora de quimica x_x. E slo que hay, tengo que hacerlo para mañana :P
gracia, es bueno se me hizo mas gacil realizar la tarea
Hola, soy profesora de física y química en galicia (España) y me gustaria felicitarte por el blog. Una idea estupenda y muy útil.
Olaz a toa la gent d ak y tbm al creador de estos articulos, m sirvieron de musho gracias ok bye saludos desde Perù ;)
TA MUY WENO CON ESTA INFORMACION YA NO TENGO Q BUSCAR MAS AQUI ESTA TODO LO K NECESITO
exellente
very good :D
noc si esta bieen o mal la info:D solo se qe me saco d un apuro y qe es lo mas facil y resumido qe encontree :D
graciaas :D
ala
n0o pues mucha s grcias
me sirviom mushisim0o
piola ps............
holaaa
muy bien la informacion me ayudo mucho..
hola odio la quimik es lo peorrrrrrrrrrrrrrrrrrrrrrrr
ESTA PAGINA ESTA SUPER CHIDA TIENE INFORMACION MAS CLARA Y PROFUNDA QUE LAS DEMAS Y SI NO TE GUSTA PARA QUE TE METES AQUI.
FELICIDADES A LOS DE ESTE BLOG CREO QUE ES UNA BUENA OPCION PARA NOSOTROS LOS ESTUDIANTES SIGAN ASI Y NO BAJEN DE CALIDAD.
muchas gracias (:
me sivio en mis problemas
(:
un saludo
muy buen aporte para la comunidad...
gracias, con esto estudie para mi examn d quimica de la uni
Esta pagina esta a todo dar ya que me sirvio de mucho en una tarea al principio se me asia super aburrida pero ya me empezo a gustar
ATTE Lineth Castillo
ola ke tal pz muxas
gracias jojo es lo ke
estaba buscando es de
lo mej0r esta pagina jojo!
alan team0o!!!!
ariel eres el amor de mi vida nunca te voy a olvidar asi estes con otra persona mi coarzon siempre va a estar contigo dejame decirte que eres una persona mut especial te kiero y ojala nunca me olvides eres lo maximo perdoname por favor
ariel eres el amor de mi vida nunca te voy a olvidar asi estes con otra persona mi corazon siempre va a estar contigo dejame decirte que eres una persona muy especial te kiero y ojala nunca me olvides eres lo maximo perdoname por favor a cuando haciamos el sexo tu eras el mejor de todas mis parejas que rico lo haciamos te amo ojala y regresemos para que hagamos el amor como perros hasta morir y si no vuelves pues voy a tener que hacerlo con tu mejor amigo lla que el lo hace estupendamente rico bueno lla me voy por que lla llego y me esta quitando la ropa y me esta penetrando justo ahora hayyyy-- juan que rico mas por fa haa--haa-haa que buene verga tienes juan pero no mejor que la tuya ariel adios pendejos
Ps EsTa pAgInA EsTa BnIsImA y pS MuChAs grASCiAs POr hAcErLA...
PoR AqUi....
eStUBo bRyaN ThE bEsT
JoJoJoJJoJoJoJO!!!!!!!!!
EsTa tAreA EsTa dE lO mEjOr!!!!
qUe bN aHoRa sOlo iMpreImO Y yA!!!
bRyAnThEbEsT JeSsiCa tE QuiErO Un reStoOoOoOo!!!!
me gusto la informaccion aunq creo q le faltaron un poco de dibujos sobre estos tipos de modelos de todo modos muxas gracias
bastaantee buenoo! ayudo muchisimoo con las cienciias=D
mee encanta esta asignatura, pero no se me da nada bien :P y aqui me han solucionado las dudas =)=)
saludoos desde andaluciia
-bsiiyoos=)
gracias la neta me ayudo un buen!
gracias
me fue de mucha ayuda
espero y sigan apoyando de esta
forma a los estudiantes
de verdad muchas gracias.
muy bonito comentario me impacto mucho gracias chuuuuuuuuuu
atte:
neisita- DE BOLIVIA
a mi no m gusta, esta mui pobre de informasion. todo lo que tinen sale en el libro de quimica 2°medio, y faltan muchos modelos atomicos, y justo los k faltan son los que nesecito
les faltaron mas modelos no tenian lo que buscaba, pero GRACIAS de todos modos
Psss...la verdad esta bien para los conformistas y aquellos resumidores extremos,deben ampliar mas la informacion sobre el modelo atomico..pero dse les agradece chauuuu..
muy bueno, me sirvio mucho...gracias
estube un monton de rato buscando sobre el modelo atomico actual.
Hola ps stuvo buena la informacion pero necesito informacion especifica de lo que iso Heisenberg y Broglie
Gracias
esta bkn y no es t an compleja l a wea como en wikipedia xD
esta pagina esta muy buena
excelente
nos sirve caleta
ademas mi profe saco la informacion de aca
para hacer una prueba xd
por que no puso el madelo atomico de yan peril
por que no puso el madelo atomico de yan peril
jaja Muy Bueno la informacion pero ay como 4 o 5 modelos mas ke no son tan importantes pero = ce neceesita saber (al menos kon el profe ke tenemos xD) Waaaa los necesito para maniana!!! pro muy bueno el blog!!!!!!!
Bueno soy un joven muy interesado en lo que es la mecanica cuantica, así que...
opino que esto es bueno, los modelos atomicos son en resumen no reales, cada gran cientifico no es que crea un modelo atomico ni lo inventa si no que lo idea es solo una forma de saber de como puede ser un atomo. algo bueno sería pensar en que un atomo no tiene forma si no que es muy extenso y es algo el cual se encuentra en todo tipo de manifestación de la materia.
Hola, muchísimas gracias por la información que no has brindado, lo felicito, muy buena redacción. Ahora, mi consulta es la siguiente: Cual es el modelo atómico mecano-cuántico?... He buscado información pero no logro comprender del todo. Por favor, podrías orientarme un poco respecto a ese tema? de antemano muchas gracias y felicitaciones por el blogspot.
Valentina.-
mil gracias!!!
me salvaste la vida!!!...
kon esto seguro y sako 10 en mi expo!!!...
mil grax brow!!!
Miguel Amadeus
migrrrmontoya @ hotmail . com
me salvaron la vida con estomuchas gracias
ahi que prestar atencion en dice el video sobre el descubrimiento del nucleo atomico no es la correcta lo demas esta bn para dar una historia corta de el atomo
Mi hermano, gracias gracias, esto fue buenisimo para una tarea, felicidades por tu blog, ojalá siga creciendo, una vez más, se te agradece desde mexico y desde el Come Tierra.
esteban te quiero hacer el amor como lo hicimos aquella ves teamo
Ohoooolaaaaa
k onda pss
muchisimas gracias
por la info
estuvo genial
me ayudo un buen a mi
tareaaaaaaa
x cierto saludos a Moy
tkmmmm x 100pre
peneeeeeeeeeee 8===D PARA EL QUE LEE Y PARA SUS MADRES JEJEJE
DALE BULLA PURA GENTE CHORA COGOTERAA A LO VIO´! LO CULIAMO A LA ZORRA Y KE PASAA!
me gusto muchisimo lastima que no encontre casi todo solamente estaba buscando lo errores del modelo atomico de Dalton, Thomson y Rutherfordgraciasssssssssssssssssssssss..................................
muchisimas graciaaaaaaaaaaaaaaas :)
falta poner los errores que cometieron cada uno de los cientificos...al realizar cada teoria
Esta muiiiii bnn hecho !! y me ayudo muchisisisimo con mi tarea (: GRACIIAS ! :D
Ps esta de lo mejor, me ahorro muchisimos trabajo.. claro y conciso... lo que es y punto.. muchas gracias y espero q me puedan seguir ayudando en mis investigaciones..
esta muy bien hecho este articulo gracias al autor x ayudarme con mi tarea..de Chile
te felicito muy buena tu pagina
men estubo muy bueno pero no me sirvio xq no encontre lo q bsucaba xD pero esta bueno el post ayuda a prepararse para una eva... jaja xD
Olaass!! buenaa la pagina igual me sirvio de muchoo!! graciiaas por la ayudaa!! :) xd
excelente información muchísimas gracias y felicitaciones al emisor
me sirvio mucho gracias 8)
me encanto como estan basada las teorias de particulas al modelo atomo y origenes de la teoria atomica de las particulas indivisibles sel atomo divisible.y el desarrollo historico del modelo atomoco de la materia
faltan nombres de los cientificos de la mecanica cuantica, igual q paja estudiarce lo hay!!!!!!!!!!
heyyyy gracias por eso me ayudo bastante en mi tarea de quimica.
ooooola lo unico q falta es el atomo actual y no ayudo en mi tarea :S
olaaa!!
mmmm..pz muxisimas graxiaz x esta inf0rmaci0n pz me sirvi0 de muxo heheh
byee) saludozzz a estad0s uniid0z
chaoo
m0niCa*
pues no me siervio de nada
vallanse a la mierda
sus viejas son re feas
aguante estudiantes de la plata (arg)
el PINCHA manda
la verdad esta del culo ponte a trabajr bien
pinche estupido
gacias chicos de este blogla tarea dme fue de mucha ayuda
esta raro
COMICO>!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!aTTE POLO POLO
COMICO!!!! ATTE: POLO POLO
nee pinche pagina mierda no me sirvio ni madres, pagina culera
no vale pito
neee chingen a su puta y rebstarda madre mejor vyanse a comoer chorizo con huevo ( de le mala forme)
atte: el que chinga a tu madre
nee hijos deputa vale madres tu pagina culera
atte choko el vaginon
P.S. parece pagina porno
pos bueno la pagina me sirvio para PERDER MI PINCHE VALIOSO TIEMPO
DEJATE DE RASCARTE LOS HUEVOS Y EMPIESA A JALAR
P:S no sirve ni pra picarte la cola
chingen a su requetecontraputabastarda madre
da la cara autor pendejo
te falto un wey que se llama chadwick
la pagina es es muy buena pero le cambiaria el nombre a de 8 a mi me lo estn passndo en 8tavo
puta e la raja wn se pusiaron culiao
pal pico
nuevo atentado preparense Osama
gracias nos sirvio muxo esta pagina nos proporciono gran informacion para hacer nuestro trabajo de quimika
haii mientras leo esta mierda..!
me estoii cojiendoo al hermanoo de mi novioo.. hayyyy--- me la mete mas adentro que el hermanoo.. hayy--
peroo por diosss briann tu hermanoo martin la tiene tan corta qe te kiero mas a voss...
hayyy---
me muerooo martin cagaste pendejooo tu hermano me coje mejor qquee voss hayyyyyyy--- briann hayy--
te amoo brian---
nunka nadie me havia echo el amor como voss..
hayy briann sisii mass mass no paress..
hayyy...
esamos con camarita si quieren ver..
hayy que suerte q martin esta de viajee..
hayyyyyyyyyyyyyyyyyyyyyy........
noo no paress hayy sesee mass mass adentro.. hayyy
u.u.. lastima martin fuiste pelotudoo..! tu hermano me la mete mejor i es mas lindoo la tiene mas larga q voss..!
le estoi haciendoo un re petteee...
mientra vos estas durmiendon lo mas tranki pelotudo...
hayyy see martin seguiii hayy.....---
hayyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyyy
gracias me salvaste de una disertacion pa mañana xD ojala me valla bien
gracias por la info.
me salbo pa la prueba
Y el mapa conseptual o el cuadro comparativo? hdp .. Para qe pones esoo gil ! Lpmhdmp
Y el mapa conseptual o el cuadro comparativo? hdp .. Para qe pones esoo gil ! Lpmhdmp
Nononnono soy profesora y creo que esta info esta muy para la mierda la re puta madre que lo re mil pario hijo de putaaaaaa !! no brindes mala info blbablaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa
putos.
muy buena la informacion gracias
MUY BUENA ESTA INFORMACION ME SIRVIO MUCHO PARA EL DEBER DE QUIMICA
lo que digan la gente que no les afecten la quimika es buena para las personas que si son inteligentes a mi me encanta la quimika y que???????????
waa!! me salve encontré acá lo que buscaba! gracias!
Wow! buen post. me sirvió muchoo :)
falta mas modelooos atomicos¡¡¡
saque poca informacion, pero la proxima vez derrepente sacarèeeeè
mas?????........
no sace mucha info....
faltan modelos atomicos
pero que importa¿gracias...ssss?
Bien chevere este sitio de web...graxias me salvaron encontre todo lo k necesitaa!!! EXITOS!!
Gracias!!! Encontre lo que buscaba y bien entendible!!! Saludos!
muy buenísimo me salvó de una tarea muy impiortantísima. sigan investiagando esto porque lo salvan de problemas muy grandes
muy buen post Ç=
jajajajajajajajajajaj
mmm.. que linda pagian.. se ve q todo sta muy bien structurado aunq no lo he leido...
que wuena sta la pag... solo imprimo l.. y ya lista la tarea.. jiji =(.
emm esta muy buena la pag y me sirvio mucho graxiaz
hola mm pues les agradesco por la ayuda que me acieron y a todos estubo muy bien formulado mm bueno hasta luego
muy bueno me sirvio aunq falto un poco de informacioen pero esta muy bien formulado gracias hasta luego
jajajajaja NOT LE ENTENDY NADA PERO GRXYAZ
Esta muy bn pero falta lo de sommerfell y wilson XD
bien bien me sirvio bastante y haora QUE TERMINE A VER PELICULAS XXX jajajaajja
neta muchas grasias por este articulo grasias a su informasion pase quimica
esta wuea vale callampa no sirve para nada
esto dice para 2º medio y a mi me lo estan passando en 8º... ahhhhh no me puedo aprender todavia estas cosaaas
tienes la ficha bibliografica del libro ??
ai gracias en serio me ayudaron con mi tarea
no entiendo los errores de bohr,no están claros
me isieron el trabajo grasias estaba bueno
superhipermega estupendo muy bien explicadeichion
y q paso con mi tarea que pedi anonimo deja huella
y q paso con mi tarea que pedi anonimo deja huella
Profesora de Prostitución has de ser , inche babosa' mal parida hjdtptmdr
pues lol ._.
gracias fue de gran ayuda los kiero
bueno pues me sirvió mucho por que me toca hacer el modelo actual del átomo y explicarlo mas q todo y pues muchísimas gracias ATT: dayanna diaz
fue algo raro pero igual me sigues gustando mauri
TODOS PIQENSE LA COLA..MAS LOS QE SON Mmo0XxhHiITtoOssSPph... .l. Jajjajjajaj Verga cabron verga .l.
que información tan avanzada
Muchas gracias
me serbio mucho para mis tareas
ezta bueno joder me zirvio a toda leche cabron,saluo pa la fifi
Les recomiendo que antes de hablar sepan escribir porque tienen unas faltas de ortografía espantosas, que refleja como es tu persona. Chicos y chicas les pido de favor que si no saben las palabras como se escriben búsquenlas porque así nunca vamos a avanzar, no es regaño es solo un consejo tómenlo a bien chavos y chavas. Las palabras se escriben así: sirvió, esta, saludos, para, cabrón, piensen, anónimo, hicieron, quiero, pinche, gracias, artículo, ahora, página, estructurado...
Faltan todavía muchos errores ortográficos, pero espero que piensen las cosas antes de escribirlas y les pido de favor que escriban bien.
Gracias por la información, muy completa y clara.Excelente la cronología de la misma.
Oye no es por nada pero hay un poco de información de los modelos atómicos en tu publicidad :v
Buenos dias. Hay un crucigrama sobre modelos atómicos que no he podido resolver.Se llama CRUCIGRAMA EL ÁTOMO. Si alguien puede ayudarme, le quedaré muy agradecido.
Interesante la forma en como haz planteado el tema, también yo he escrito uno sobre la estructura atómica y el modelo atómico, está en esta pagina pos si gustan ver el contenido. https://www.quimicaparaingenieros.com/estructura-de-los-atomos/
Sos genial
Nepe
me sirve de mucho gracias
Saca resume o lee y lo que entiendas lo escribes hasi ye ahorras copiar todo ok saludos
Publicar un comentario