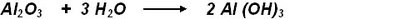
Con más propiedad podrían definirse como combinaciones entre cationes metálicos y aniones OH-.
Se nombran con la palabra hidróxido seguida de la partícula de el nombre del metal; si este posee más de una valencia, esta se indica en cifras romanas (notación Stcok) detrás del nombre del metal, auque también pueden ser nombrados utilizando la nomenclatura tradicional.

La mayoría de dichas sustancias manifiestan propiedades básicas en disolución acuosa debidas a la común posesión de iones OH-, pero debe tenerse presente que mientras casi todos los hidróxidos son bases, no todas las bases son hidróxidos, siendo el aminíaco (NH3) la más característica de todas las que cumplen esta úlima condición.
Actividad:
1. Escriba el nombre de los siguientes hidróxidos. Pinche aquí
2. Escribe la fórmula correspondiente. Pincha aquí
2. Oxiácidos: Son compuestos químicos que provienen de la combinación de un óxido ácido (anhídridos) con el agua, por lo que están formados por hidrógeno, oxígeno y un no metal. Su fórmula general es: HxNMyOz
La nomenclatura de este tipo de compuestos puede realizarse a través de la nomenclatura tradicional, que predomina sobre la IUPAC. Sin embargo, la IUPAC recomienda el uso gradual y creciente del principio de coordinación generalizado que ya explicaremos más adelante.
Nomenclatura tradicional
Para aprender a formular este tipo de compuestos hay que conocer los números de oxidación con que los no metales pueden actuar. Estos son los siguientes:
 Ejemplos de oxiácidos más comunes por grupos:
Ejemplos de oxiácidos más comunes por grupos:
HALÓGENOS: números de oxidación: +1, +3, +5, +7. Dan oxiácidos con Cl, Br, I pero non o F.

CALCÓGENOS: números de oxidación: +4, +6. Estudiaremos los oxiácidos do S, Se, Te.

NITROGENOIDES: números de oxidación: +3, +5. Estudiaremos los oxiácidos del N, P, As.

CROMO 
MANGANESO
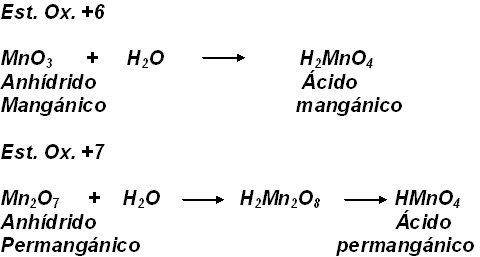
Es también imporatnte conocer el significado de los prefijos que aparecen en las denominaciones clásicas, a saber:
a) Tioácidos: El prefijo tio delante del nombre de un ácido significa la sustitución de oxígeno por azufre.
b) Peroxoácidos: El prefijo peroxo delante del nombre de un ácido significa la sustitución de un grupo - O - por el grupo - O - O - (peroxo).

c) Diácidos: Proceden de la condensación de dos moléculas de ácido con pérdida de una molécula de agua.

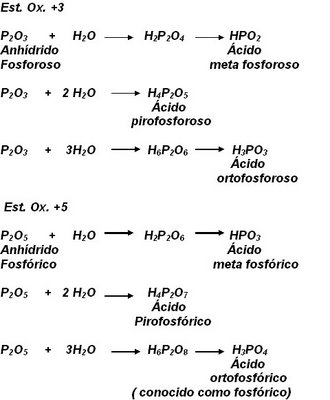
d) Ciertos elementos no metálicos pueden formar más de un oxiácido con una de sus valencias, por lo general tres, denominándose meta, piro y orto respectivamente, cuando se combinan con 1, 2 y 3 moléculas de agua. Es decir, dichas formas derivan de un distinto grado de hidratación de los correspondientes óxidos ácidos. Los elementos más importantes que presentan dicha propiedad son el fósforo, arsénico, boro, antimonio, silicio, etc.
3. Sales ternarias: Son compuestos resultantes de la sustitución del hidrógeno de los oxiácidos por metales, por lo que su fórmula general sería MxNMyOz.
Se denominan de acuerdo con el nombre del ácido terminado en ito o ato (correspondiente a las terminaciones primitivas oso, para la valencia menor e ico para la valencia mayor) seguido de la preposición de y el nombre del metal en numeral romano (notación Stock), aunque también pueden nombrarse por la nomenclatura tradicional.El metal (parte electropositiva) se coloca delante en las fórmulas. Si se trata de sales dobles se colocan los metales en orden creciente de valencia y si son del mismo grupo en orden decreciente de su número atómico.

Ejemplo de sales dobles

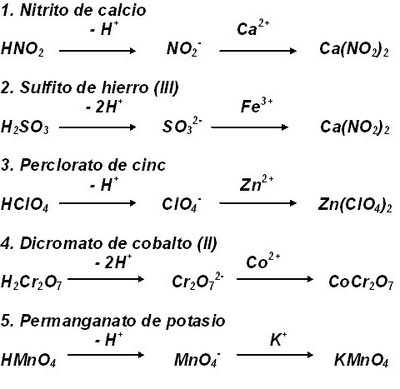
Deducción de las fórmulas de algunas oxisales
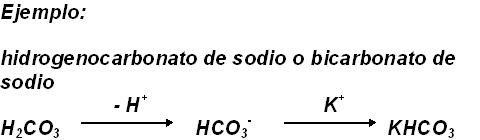
Sales ácidas: Resultan de la sustitución parcial del hidrógeno sustituible de un ácido por metales. Se nombran anteponiendo la palabra hidrógeno inmediatamente antes del nombre del anión seguida de la preposición de y el nombre del metal (notación Stock). En la fórmula el hidrógeno se coloca a continuación del metal, inmediatamente antes del anión. Dichos compuestos se nombraban clásicamente empleando el prefijo bi.