En 1897, Thomson ideó una serie de experiencia con los rayos catódicos observados, por Crooke, en tubos de descarga que contenían un gas a baja presión y al cual se les aplicaba un alto voltaje. Estas radiaciones que salen del cátodo (polo negativo) y se dirigen al ánodo (polo positivo), fueron determinadas por Thomson como partículas negativas a los que llamó electrones.

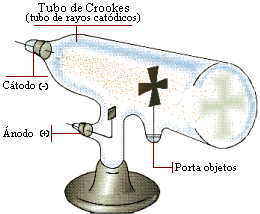 Thomson llegó a tal conclusión, debido al observar que estos rayos de luz eran desviados de su trayectoria rectilínea, tanto por un campo eléctrico como magnético, fue capaz de dilucidar su naturaleza. Como la luz ordinaria no es afectada por un imán, los rayos catódicos correspondían entonces a una propiedad de la materia y no de la luz. Posteriormente Mllikan determinó su carga eléctrica igual a 1,6*10-19 coulomb.
Thomson llegó a tal conclusión, debido al observar que estos rayos de luz eran desviados de su trayectoria rectilínea, tanto por un campo eléctrico como magnético, fue capaz de dilucidar su naturaleza. Como la luz ordinaria no es afectada por un imán, los rayos catódicos correspondían entonces a una propiedad de la materia y no de la luz. Posteriormente Mllikan determinó su carga eléctrica igual a 1,6*10-19 coulomb. Propiedades de los rayos catódicos:
- Se desplazan en línea recta, proyectan sombras, se hallan formados por partículas materiales.
- Ponen incandescentes placas metálicas.
- Producen fluorescencia.
- Son también capaces de impresionar placas fotográficas.
Las propiedades inherentes a los rayos catódicos permanecen invariables cualquiera que sea el gas contenido en el interior del tubo, lo que prueba que las partículas que los constituyen son comunes a todas las clases de materia. La carga eléctrica del electrón es la cantidad de masa eléctrica menor que se conoce; por eso se llama carga elemental.
Observaciones:
A fines del siglo XIX, los rayos catódicos fueron excelentes fuentes de investigación. En 1895, Wilhelm Roentgen (1845-1923), estudiando los rayos catódicos, observó que una lámina recubierta con ciano de bario, que estaba a una cierta distancia del tubo de descarga, emitía una fluorescencia verdosa. “Corresponden a unos rayos que atravesaban los materiales menos densos, como la madera, pero no pasan a través de los más densos, como los metales. Además no sufren desviaciones por efecto de campos eléctricos o magnéticos. Por estas características, estos rayos no deberían estar formados por partículas cargadas; son como rayos de luz”- informaba Roentgen-. Él apenas tenía idea de cuál era la naturaleza de esos rayos, así que los llamó Rayos X.
b) Descubrimiento del protón:
En 1886, Eugen Goldstein (1850-1930) utilizó un tubo de rayos catódicos con el cátodo perforado y observó otro tipo de rayos que procedían del ánodo (+); éstos atravesaban las perforaciones del cátodo iluminando la zona posterior del tubo. A estos rayos les llamó rayos canales. Se les llama canales por la propiedad de atravesar pequeños agujeros o canaletas en el cátodo correspondiente. Goldstein postuló que estos rayos estaban compuestos por partículas positivas, que posteriormente se les llamó protones.
Las propiedades que poseen estos rayos son las siguientes:
- Sufren desviación por efecto de campos eléctricos y magnéticos.
- Transportan carga positiva.
- La razón carga/masa es mucho menor que el valor obtenido para los electrones y depende del gas contenido en el interior del tubo.
Observaciones:
Los descubrimientos del electrón y del protón revelaron que el átomo tendría una estructura compuesta, que contiene electrones y protones en igual número para hacer un todo eléctricamente neutro.
c) Descubrimiento del núcleo atómico:
Pocos meses después del descubrimiento de los rayos X, el físico francés Henri Becquerel (1852-1908) observó que unas placas fotográficas se ennegrecían en contacto con cierta radiación que emitían algunas sales de uranio, la pechblenda, descubriendo accidentalmente la readiactividad. A este hallazgo se siguieron otros realizados por Marie Curie (1867-1934) y Pierre Curie (1859-1906), quienes aislaron otros dos elementos que emitían el mismo tipo de radiación: el polonio y el radio. A estos elementos se les llamó elementos radiactivos; los átomos que los conforman se desintegran espontáneamente, produciendo diferentes tipos de radiaciones alfa, beta y gamma. 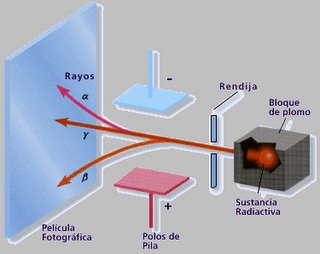
Cuando la emisión radiactiva de un mineral de uranio se hace pasar a través de un campo eléctrico, ésta se divide en 3 tipos de radiaciones: una es atraída hacia la placa negativa (radiación alfa), otra hacia la placa positiva (radiación beta) y la tercera no es desviada por el campo (radiación gama) El conocimiento de las emisiones radiactivas sirvió para postular un nuevo modelo atómico.
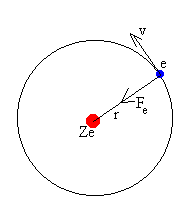
Con el fin de aclarar un poco más las características de la estructura interna del átomo, en 1909 Ernest Rutherford (1871-1937) llevó a cabo un experimento notable. Estudiando el poder de penetración de las partículas alfa (α) emitidas por una fuente radiactiva, bombardeó con ellas, finísimas láminas de oro, para analizar sus átomos.
Los resultados de Rutherford fueron impresionantes.

La mayoría de las partículas atravesaban la lámina sin sufrir ninguna desviación y sin perder velocidad. Cuando las partículas alfa chocaban contra la pantalla fluorescente (revestida en sulfuro de cinc) se producía un destello de luz.
Algunas partículas alfa eran desviadas de su trayectoria (aproximadamente 1 de cada 10000 partículas alfa).
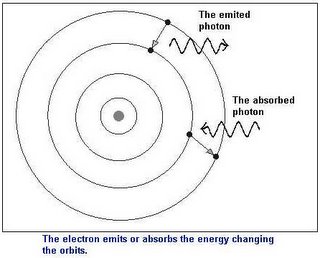
En base a los resultados, Rutherford postuló que el átomo está formado por una región central positiva, a la que llamó núcleo, la cual reúne la mayor parte de la masa atómica; es decir, la masa de los átomos depende directamente de la masa del núcleo. También planteó la existencia de los electrones, partículas negativas que se mantienen girando en torno al núcleo atómico.
d) Átomos de un mismo elemento:
Frederick Soddy (1877-1956) demostró, experimentalmente, que los átomos de un mismo elemento no tienen, necesariamente, la misma masa. Por ejemplo, el elemento neón está compuesto de 3 tipos de átomos, algunos de ellos tienen un número másico igual a 20; y otros, 21 y 22. Como el neón tiene un número atómico igual a 10, todos los átomos del elemento neón tienen 10 protones en su núcleo y solo difieren en el número de neutrones.
Soddy inventó el término isótopos (del vocablo iso que significa igual y topos, lugar) para describir a los átomos de un mismo elemento que contienen diferente número de neutrones en su núcleo.
e) Descubrimiento del neutrón:
En 1932, el inglés James Chadwick (1891-1974) comprobó, al bombardear átomos de berilio con partículas alfa de alta energía, la emisión de partículas neutras: los neutrones.

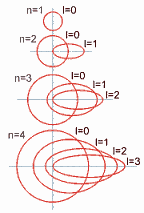
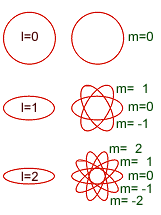

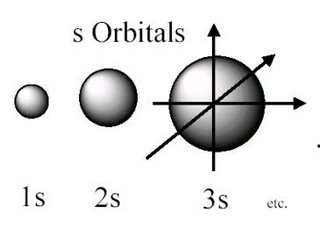
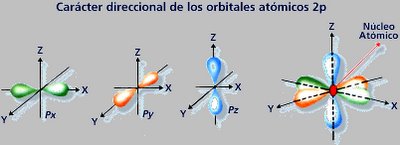
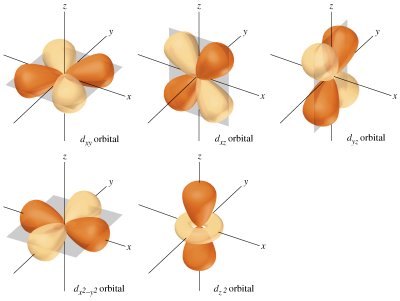
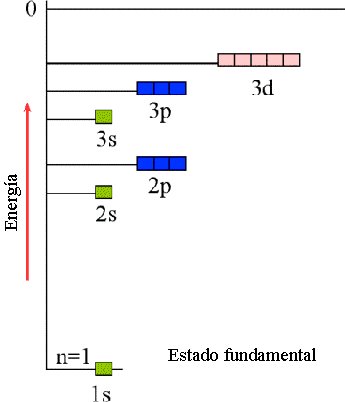
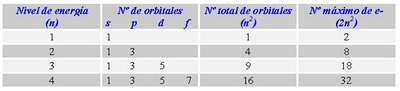
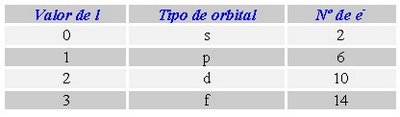 Cuadro que resume los orbitales que hay en cada nivel de energía y la capacidad máxima de electrones que pueden contener los niveles y subniveles de energía.
Cuadro que resume los orbitales que hay en cada nivel de energía y la capacidad máxima de electrones que pueden contener los niveles y subniveles de energía.