Hace fines del siglo XVII, el agua era considerada un elemento, es decir, una sustancia formada por una sola clase de átomos. Sin embargo, en 1781, el químico inglés Henry Cavendish demostró que el agua se formaba durante la combustión del gas hidrógeno. Cavendish afirmaba: si el hidrógeno arde es porque reacciona con el oxígeno del aire formando el agua. Ahora bien, como las propiedades del agua son distintas a las de los gases hidrógeno y oxígeno (ambos elementos), el agua no es una mezcla: es un compuesto (sustancias formadas por distintas clases de átomos). En la actualidad, a través de un proceso llamado hidrólisis es posible demostrar que los elementos constitutivos de agua son el H y O. El procedimiento consiste en descomponer el agua, aplicando corriente eléctrica para obtener hidrógeno y oxígeno gaseoso. 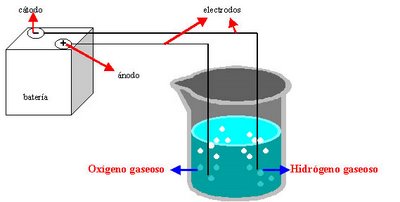

La estructura de la molécula del agua está formada por dos átomos de hidrógeno y uno de oxígeno los cuales se unen a través de un enlace covalente polar, dando como resultado una molécula de geometría angular, es decir, los átomos de hidrógeno están separados por un ángulo de 105º.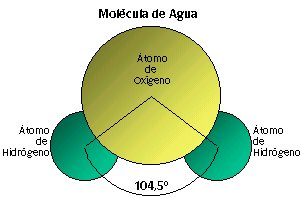

Por otra parte, como sabemos, su fórmula química es H2O, que nos indica que la proporción de hidrógeno y oxígeno en la molécula de agua es 2: 1.
Si comparamos los átomos de H y O, veremos que este último es un átomo de mayor tamaño, y por lo mismo, tiene más electrones o densidad electrónica que el átomo de hidrógeno. Esta característica determina que la molécula de agua sea polar, es decir, sobre el átomo de oxígeno hay una densidad electrónica mayor que genera una carga parcial negativa. Dicho de otro modo En el enlace químico que se forma entre el O y H participan los electrones del nivel más externo de sus átomos, los cuales son atraídos fuertemente hacia el oxígeno debido a su mayor electronegatividad (tendencia de un átomo para atraer electrones) lo que implica una polarización del enlace, es decir, el oxígeno adquire carga parcial negativa y el hidrógeno caraga parcial positiva. Estos enlaces polarizados y la naturaleza angular de la estructura de la molécula de agua dan lugar a un tipo de molécula polar. Esto significa que la molécula de agua tiene carga postiva hacia el extremo donde se encuentran los átomos de hidrógeno y carga negativa hacia el extremo contraio donde se ubica el átomo de oxígeno.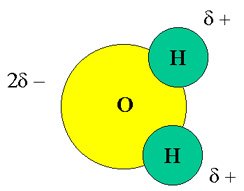
Si comparamos los átomos de H y O, veremos que este último es un átomo de mayor tamaño, y por lo mismo, tiene más electrones o densidad electrónica que el átomo de hidrógeno. Esta característica determina que la molécula de agua sea polar, es decir, sobre el átomo de oxígeno hay una densidad electrónica mayor que genera una carga parcial negativa. Dicho de otro modo En el enlace químico que se forma entre el O y H participan los electrones del nivel más externo de sus átomos, los cuales son atraídos fuertemente hacia el oxígeno debido a su mayor electronegatividad (tendencia de un átomo para atraer electrones) lo que implica una polarización del enlace, es decir, el oxígeno adquire carga parcial negativa y el hidrógeno caraga parcial positiva. Estos enlaces polarizados y la naturaleza angular de la estructura de la molécula de agua dan lugar a un tipo de molécula polar. Esto significa que la molécula de agua tiene carga postiva hacia el extremo donde se encuentran los átomos de hidrógeno y carga negativa hacia el extremo contraio donde se ubica el átomo de oxígeno.

Del mismo modo que existen las uniones interatómicas, hay otras: las uniones intermoleculares, que permiten mantener unidas las moléculas de un compuesto. Dadas las características de polaridad de la molécula de agua, la unión se establece por medio de una fuerza de atracción intermolecular llamada enlace por puente de hidrógeno.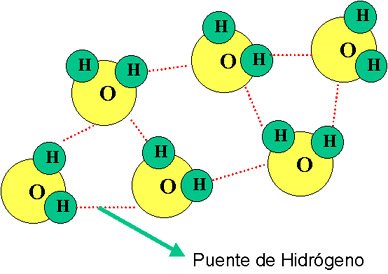

Dicho de otro modo, el extremo positivo de una molécula de agua resulta fuertemente atraído por el extremo negativo de otra molécula de agua cercana de forma que con las moléculas del entorno próximo se forman redes de moléculas unidas entre sí a través de un tipo de enlace especial llamado enlace por puente de hodrógeno.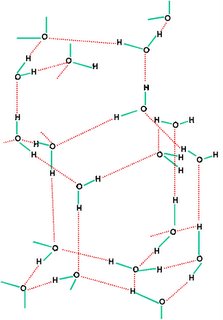
una mierda
ResponderBorrarMuy bueno me sirvio muchisimo gracias
ResponderBorrarel profesor de quimica lantera... nos mando a hacer esto y nunca lo hemos dado, ni siquiera es capaz de decirnos en que pagina esta para cada grupo.. bien profe bien... con profesores asi ni ganas de estudiar
ResponderBorrarLa informacion me fue de gran utilidad, muchas gracias .
ResponderBorrarMui bueno. Gracias
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarmui bueno:P
ResponderBorraresta bueno
ResponderBorrarrhfjhnf,gn,dn,nbd,nlngdljblndlnggn jbfgdblgndkn
ResponderBorrarYo No Entendi Muy Bien, Deberian Explicar Mejor Utilizando Palabras Mas Comunes & De La Manera Mas Corta Posible, Porque Hay Mucha Informacion Y Uno Se Confunde.
ResponderBorrarEso no es la Hidrólisos, malísimo.
ResponderBorrargracias
ResponderBorrarexcelente explicacion..!!
ResponderBorrarLe recomendé este blog a mis alumnos de química y les fue muy util muchisisimas gracias!
ResponderBorrarKippot4less
practico me gusto ;)
ResponderBorrarEste es una información buena pero me suena a información que tomaste de un profesor.
ResponderBorrar