1. Punto de fusión y ebullición: El agua tiene puntos de ebullición y de fusión más elevados que la mayoría de los líquidos. A nivel del mar, el punto de ebullición del agua es 100º C y el de fusión es 0º C.
Recordemos que el punto de ebullición (p.e) de un líquido es la temperatura a la cual la presión de vapor del líquido se iguala a la presión atmosférica que se ejerce sobre dicho líquido. La presión que actúa sobre un líquido influye significativamente sobre su punto de ebullición. El agua hierve (ebulle) a 100 ºC si está sometida a una presión de 1 atmósfera, sin embargo, si la presión disminuye hasta 0,06 atmósferas, la ebullición se produce a 0 ºC. Es por eso que en lugares cada vez más altos, donde la presión es cada vez menor, el agua puede ebullir a temperaturas menores a 100 ºC.
Los elevados puntos de ebullición y fusión del agua se deben a que la molécula es altamente polar y que sus estados líquido y sólido las moléculas de agua se asocian fuertemente mediante puentes de hidrógeno.
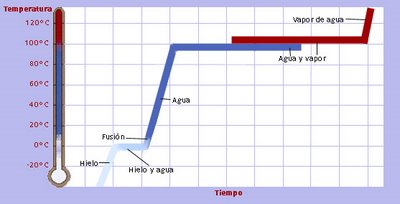
Si se calienta una masa de hielo, su temperatura aumenta gradualmente hasta que alcanza 0°C en que el hielo comienza a fundirse. Durante la fusión, la temperatura permanece constante (punto de fusión) porque el calor absorbido por la masa se emplea en vencer las fuerzas de atracción entre las moléculas de agua del hielo. Una vez que la masa se ha fundido totalmente, el calor absorbido aumenta la energía cinética de las moléculas de agua y la temperatura aumenta hasta llegar a 100°C, donde comienza la ebullición. Durante ésta la temperatura permanece constante (punto de ebullición) porque el calor se está empleando para superar las fuerzas de atracción entre las moléculas al estado líquido. Cuando las moléculas están en fase vapor, la temperatura aumenta de nuevo.
2. Densidad: Es otra propiedad que permite identificar una sustancia. Para conocer su valor se debe tener la masa y el volumen. La densidad del agua a 4º C es 1g / mL.
Durante el proceso de enfriamiento del agua desde los 100 ºC, se produce una contracción de volumen (aumenta la densidad) hasta llegar a la temperatura de 3,98 ºC (casi 4 ºC) en que alcanza su máxima contracción (máxima densidad), ya que al continuar enfriando, vuelve a dilatar su volumen (disminuye su densidad) hasta que se solidifica. El paso de agua líquida al hielo (a 0 ºC) va acompañado de un aumento considerable de volumen, disminuyendo significativamente su densidad. Debido a lo anterior, el hielo flota en el agua y produce importantísimos fenómenos mecánicos de rotura y disgregación de las rocas.
Además, el agua tiene otra propiedad importante: puede mantenerse muchos grados bajo cero sin solidificarse. Al contrario de los que sucede en la mayoría de los líquidos (que no se dilatan al molificarse).

3. Tensión superficial: Las moléculas en la superficie de un líquido se comporta en forma diferente a las que se encuentran en su interior. Estas últimas interactúan con otras moléculas en todo su entorno, en cambio, las de la superficie del líquido sólo son afectadas por las moléculas que se encuentran debajo y a los lados. Esto produce una fuerza de atracción neta hacia el interior sobre las moléculas de la superficie, contrayendo la superficie y produciendo un efecto como si fuera una membrana elástica.

La tensión superficial es la energía requerida para expandir una superficie líquida y es más alta para los líquidos que poseen atracciones intermoleculares fuertes. La tensión superficial es alta debido a la polaridad de sus moléculas y al gran número de puentes de hidrógeno que aumentan la cohesión de las moléculas entre sí. Precisamente las gotas de agua son esféricas debido a su elevada tensión superficial. Por esta misma razón, el agua es capaz de mantener sobre ella pequeños objetos que tienen mayor densidad.
Pincha sobre el video donde se aprecia la tensión superficial del agua.
Powered by Castpost
4. El agua posee una alta capacidad calorífica: Cuando se calienta un material, aumenta su temperatura, pero la cantidad de calor necesario para elevar la temperatura es diferente en cada sustancia: algunos materiales necesitan mucha energía térmica para elevar su temperatura y otros menos. Para medir esta propiedad en las sustancias se utiliza una magnitud llamada Capacidad Calorífica Específica y se define como el calor necesario para elevar la temperatura de un gramo de una sustancia en un grado Celsius. Cada sustancia tiene una capacidad calorífica diferente.
La capacidad calorífica del agua es muy alta lo que se debe a sus enlaces por puente de hidrógeno. Esta característica del agua se manifiesta en que es preciso transferir más energía térmica para fundir el hielo, calentar y vaporizar agua, que para hacer lo mismo con casi cualquier otra sustancia.

14 comentarios
muy buena información, gracias
Muy bien explicado, gracias!
¿algun autor o fecha de publicacio?
El agua en ebullicion es fusion o vaporizacion?
Buenisima explicación, mucha gracias al que lo hizo :). Me ayudo bastante.
Muchas gracias se los agradezco
En la parte de arriba dice
Vaporización
Hola !! Consulta,porque cuando hierve el agua en una olla de acero quirúrgico 18/10 (interior mate)y base ancha , el agua muestra una tonalidad menos clara que en una olla de acero simple(económica), Pulido espejo en su interior y base delgada ??
Gracias por la información, me ayudó bastante con mi tarea<3
Jaja reprobó
Por cierto soy José xdxd
Hola consulta ¿es cierto q la sustancia q tiene mayor punto de ebollucion es la q tiene mayor diferencia de temperatura entre sus PE y PF???
A que temperatura el agua presenta mayor densidad ?
La respuesta la tendrás al cambiar de olla, simplemente es el fondo del material utilizado.
Publicar un comentario