La figura anterior representa el orbital de mínima energía del átomo de hidrógeno. Mientras que el modelo de Bohr utilizaba un número cuántico(n) para definir una órbita el modelo de Schrödinger utiliza tres números cuánticos para describir un orbital: n, l y ml . A continuación vemos las características de estos números:
- Número cuántico principal (n):Representa al nivel de energía (estado estacionario de Bohr) y su valor es un número entero positivo (1, 2, 3, 4, etc) y se le asocia a la idea física del volumen del orbital. Dicho de otra manera el número cuántico principal determina el tamaño de las órbitas, por tanto, la distancia al núcleo de un electrón vendrá determinada por este número cuántico. Todas las órbitas con el mismo número cuántico principal forman una capa. Su valor puede ser cualquier número natural mayor que 0 (1, 2, 3...) y dependiendo de su valor, cada capa recibe como designación una letra. Si el número cuántico principal es 1, la capa se denomina K, si 2 L, si 3 M, si 4 N, si 5 P, etc.
- Número cuántico secundario (l):
Identifica al subnivel de energía del electrón y se le asocia a la forma del orbital. Sus valores dependen del número cuántico principal "n", es decir, sus valores son todos los enteros entre 0 y (n-1), incluyendo al 0. Ejemplo: n = 4 ; l = 0, 1, 2, 3. Dicho de otra manera, El número cuántico azimutal determina la excentricidad de la órbita, cuanto mayor sea, más excéntrica será, es decir, más aplanada será la elipse que recorre el electrón. Su valor depende del número cuántico principal n, pudiendo variar desde 0 hasta una unidad menos que éste(desde 0 hasta n-1). Así, en la capa K, como n vale 1, l sólo puede tomar el valor 0, correspondiente a una órbita circular. En la capa M, en la que n toma el valor de 3, l tomará los valores de 0, 1 y 2, el primero correspondiente a una órbita circular y los segundos a órbitas cada vez más excéntricas.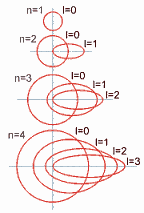
- Número cuántico magnético (m): Describe las orientaciones espaciales de los orbitales. Sus valores son todos los enteros del intervalo (-l,+l) incluyendo el 0.Ejemplo: n = 4l = 0, 1, 2, 3m = -3, -2, -1, 0, +1, +2, +3. Dicho de otra manera, El número cuántico magnético determina la orientación espacial de las órbitas, de las elipses. Su valor dependerá del número de elipses existente y varía desde -l hasta l, pasando por el valor 0. Así, si el valor de l es 2, las órbitas podrán tener 5 orientaciones en el espacio, con los valores de m -2, -1, 0, 1 y 2. Si el número cuántico azimutal es 1, existen tres orientaciones posible (-1, 0 y 1), mientras que si es 0, sólo hay una posible orientación espacial, correspondiente al valor de m 0.
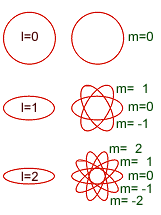
El conjunto de estos tres números cuánticos determinan la forma y orientación de la órbita que describe el electrón y que se denomina orbital. Según el número cuántico azimutal (l), el orbital recibe un nombre distinto. cuando l = 0, se llama orbital s; si vale 1, se denomina orbital p, cuando 2 d, si su valor es 3, se denomina orbital f, si 4 g, y así sucesivamente. Pero no todas las capa tienen el mismo número de orbitales, el número de orbitales depende de la capa y, por tanto, del número cuántico n. Así, en la capa K, como n = 1, l sólo puede tomar el valor 0 (desde 0 hasta n-1, que es 0) y m también valdrá 0 (su valor varía desde -l hasta l, que en este caso valen ambos 0), así que sólo hay un orbital s, de valores de números cuánticos (1,0,0). En la capa M, en la que n toma el valor 3. El valor de l puede ser 0, 1 y 2. En el primer caso (l = 0), m tomará el valor 0, habrá un orbital s; en el segundo caso (l = 1), m podrá tomar los valores -1, 0 y 1 y existirán 3 orbitales p; en el caso final (l = 2) m tomará los valores -2, -1, 0, 1 y 2, por lo que hay 5 orbitales d. En general, habrá en cada capa n2 orbitales, el primero s, 3 serán p, 5 d, 7 f, etc.
Número cuántico de espín (s): Describe el giro del electrón en torno a su propio eje, en un movimiento de rotación. Este giro puede hacerlo sólo en dos direcciones, opuestas entre sí. Por ello, los valores que puede tomar el número cuántico de spin son -1/2 y +1/2. Dicho de otra manera, Cada electrón, en un orbital, gira sobre si mismo. Este giro puede ser en el mismo sentido que el de su movimiento orbital o en sentido contrario. Este hecho se determina mediante un nuevo número cuántico, el número cuántico se spin s, que puede tomar dos valores, 1/2 y -1/2.
Según el principio de exclusión de Pauli, en un átomo no pueden existir dos electrones con los cuatro números cuánticos iguales, así que en cada orbital sólo podrán colocarse dos electrones (correspondientes a los valores de s +1/2 y -1/2) y en cada capa podrán situarse 2n2 electrones (dos en cada orbital).
Representaciones de los Orbitales
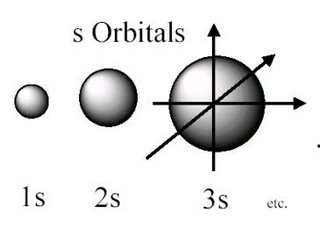
- Orbitales "s": Los orbitales "s" son esféricamente simétricos.
- Orbitles "p": La forma de los orbitales p es de dos lóbulos situados en lados opuestos al núcleo. Hay tres tipos de orbitales p ( ; ml= -1,0,1) que difieren en su orientación. No hay una correlación simple entre los tres números cuánticos magnéticos y las tres orientaciones: las direcciones x, y y z. Los orbitales p del nivel n se denominan npx, npy, npz
Los orbitales p al igual que los s aumentan de tamaño al aumentar el número cuántico principal.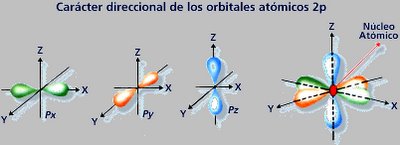
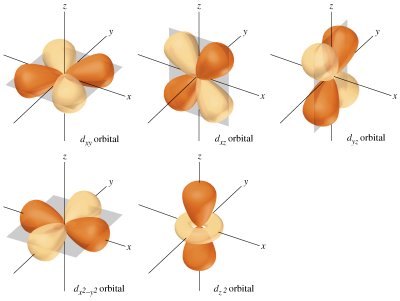
- Orbitales "d": En el tercer subnivel tenemos 5 orbitales atómicos (para n>3 l =2; ml=-2,-1,0,1,2) con diferentes orientaciones sen el espacio tal y como vemos en la figura :
- Orbitales "f": Son orbitales de mayor energía. Para n>4 tendremos 7 orbitales f ( =3 y ml=-3,-2,-1,0,1,2,3) . Los orbitales f son importantes para comprender el comportamiento de los elementos con número atómico mayor a 57.
Observaciones:
Para valores de >4 tenemos los orbitales g y subsiguientes (a partir de f sigue el orden alfabético de las consonantes). En química general nos bastará con los orbitales s, p y d para comprender las propiedades de los elementos.
Las energías de los orbitales atómicos
En el modelo de Bohr la energía de un electrón dependía únicamente del número cuántico principal. Lo mismo ocurre en la descripción de los orbitales atómicos en mecánica cuántica para el átomo de hidrógeno.
Para átomos con más de un electrón (polielectrónicos) los orbitales atómicos tienen la misma forma que los orbitales del átomo de hidrógeno, pero la presencia de más de un electrón afecta a los niveles de energía de los orbitales (debido a la repulsión entre dos electrones).
Así por ejemplo el orbital 2s tienen un valor de energía menor que los orbitales 2p para átomos con más de un electrón: 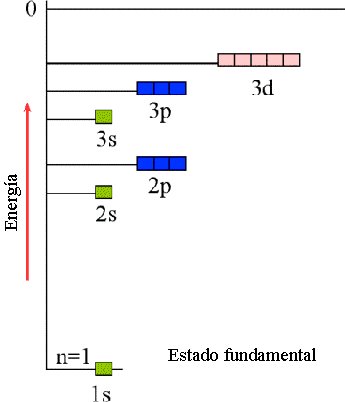
Por lo tanto, la combinación de n y l describe a un orbital que es la región del espacio en la que es más probable encontrar al electrón y en la cual tiene una cantidad específica de energía. El valor que tome el número cuántico secundario (l) determina el tipo de orbital:
 Cuadro que resume los orbitales que hay en cada nivel de energía y la capacidad máxima de electrones que pueden contener los niveles y subniveles de energía.
Cuadro que resume los orbitales que hay en cada nivel de energía y la capacidad máxima de electrones que pueden contener los niveles y subniveles de energía.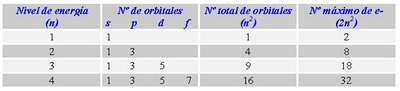
Powered by Castpost
Actividad:Conocer los posibles valores de los números cuánticos y la representación geométrica de los orbitales. Para desarrollar la actividad pinche sobre actividad.

92 comentarios
HOLA me llamo ricardo ramirez soto , quien se esta preparando duro y parejo para ingresar a la uni ,siempre cuando tengo tiempo me paseo por paginas de diversos asignaturas , me parece que esta es una muy buena , deberia aumentar mas temas y poner opiniones de cientificos como stephen hawking y otros muy famosos de la epoca. felicitaciones
hola ME PAREC E QUE ESTA PAGINA ES MUY INTERESANTE Y ME AYUDO MUCHO
GRACIAS
Hola, me llamo Alejandro Serrano H., y me parece muy buena la pagina, la explicanción de los diferentes conceptos es sencilla y de facil asimilación.
hola me parece super buena la pagina ya que a mi me ayudo bastante en mis trabajos todo eso del colegio eso na mas que decir chao
me paresio muy interedante me ayudo mucho en mis tares grasias
Olaz...[!*
ma yudO dmzz n mi tarerea d kimik...sigan arraglandO su pag i pOngan maz artikulOz pz...
hola me llamo mari y esta pagina es espectacular para uno aprender mucho me gusta para saber mas en quimica y muchas materia mas
ESTA PAGINA ES MUY BUENA
;D
atte: Pamela
Hola
esta pagina esta genial
aki are mis tareas :D
Gracias por hacer un blog de química, me ha ayudado mucho, sigue asi!!!
Esta página es de las mejores que he encontrado para mi estudio. Los temás estan muy bien organizados y explicados. Gracias por dar la oportunidad de aprender en esta web. Genial la explicación visual al final. Ojala propongan diferentes temas con explicaciones tan precisas.
Felicidades
me parece excelente su blog, por casualidad no tendran la forma del orbital g y h? la necesito y aun no la encuentro gracias
HOLA ME LLAMO FELIX GONZALEZ, Y ESTUVE INVESTIGANDO SOBRE ESTE TEMA Y ESTA PAGINA ME PARECE EXCELENTE. MUCHAS GRACIAS POR AYUDARME.
pta qe asssssssco pon ejercicios resltos pe webonn!! Dacnoreh xD jojoj
hola escribo desde el estado de nayarit y esta pagina esta genial y es suoer rapido encuntrar lo que bescas de una manera exacte y clara atte: rodriguez cruz sammy
el documento es muy bueno no obstante quisiera que de forma especifica expusieran como se determina en SI un numero cuantico.
gracias...
hola me gusto mucho su pagina porque tiene un verdadero interés en la superación de la educación.
que la joooooda estaa paginaa chee!.. ej increible taanta informacion en una sola pagina!
creo q ya tengo mi vida realizada gracais a essta pagina..creo q ni voy a ir a trabajar..! pq esta pagina es muy dable! creo q ni voy a pagarme una universidad! pq noo diganojj!
me cago en esta pagina! est muy buena! ya ni voy a estudiar por nada mas!
ola
me
llamo omar
qieres viaitar
mi
metro
es
www.metroflog.com/diablito_swk
bueno esta pag.
me
ayudo
mucho
gracias.
fimemen
chido
olap m iamo isa zoi de la cd d tampico tamaulipas sta pagina cm izo mui interesante me aiudo muxo ^^ spero k pz sem kede algo d lok aprendi jojojojoj n_n´
bye bye qidnc bxxozzz ^^
olap m iamo isa zoi de la cd d tampico tamaulipas sta pagina cm izo mui interesante me aiudo muxo ^^ spero k pz sem kede algo d lok aprendi jojojojoj n_n´
bye bye qidnc bxxozzz ^^
este es mi numeeroi de telefono escribemer es muy buena tu paginba te quiero 04164799666 y 04264768965 espero tus mensajes o llamada
muchas gracias!Me ayudo muchisimo...
ps no se me parese bn la pagina pero bisiten la mia en el metroflo.com es mentitacoll..
MUCHAS GRACIAS ESTA PAGINA ME AYUDO DE MUCHO
gracias por la informacion... esta informacion me ayuda mucho
gracias
la pagina me ayudo bastante con el trabajo que tengo q hacer
arigatou ★★★★
ho0la
muchisssiiiiciiimas gracias
me salvaste la vida
xD
aclaré dudas sobre los números cuánticos nunca habia visto eso....me parece interesante gracias por publicarla SALUDES AL COLEGIO EL ROSARIO en barranca colombia.
gracias por las respuestas
GRACIAS Me ayudó muchísimo, espero que amplien esta página y con más temas
ola me llamo camila manriquez y esta pagina con el contenido me ayudo mucho, por que como no entendia bien, pero ahora me quedo muy claro...
gracias!
Esta mierda no se encuentra nadade lo que uno busca cueputa
muy buena la pág!!! me ayudó demasiadooo!!! proque en mi libro no salía bien explicado !!! xP...entonces comencé a buscar y me pasé por aquí!!!! O.O...y está excelente!! ^.^ hice toda mi tarea como niña buena xD!!! gracias me aydú muchiiiisisisisisisimo!!!
Me llamo Mabel Estefanía Soto Elgueta...^.^ soy de Chile, Osorno...mi face es Mabe Billnática Soto Elgueta...mi msn es stefy.pa.ty@hotmail.com...y el otro es Billnatica.TH@hotmail.es ...agreguenme si quieren ^.^ jajajja..así me ayudan en mis tareas también cuando yo no sepa donde buscar xP bueno esoo byee ;)
Hola me llamo romina :) la pagina esta muy buena :) me sirvió mucho para prepararme para mi prueba felicito al que creo la pagina :D
YO NO ENTENDI BIEN LA PELICULA... LA POLICIA SABIA DE ASUNTOS INTERNOS?
he encontrado varias cosas interesantes. yo creo que un pedagogo tiene que que juntar los conocimientos del alumno para formar una vision panorámica de todos ellos. El alumno generalmente tiene las piezas de un rompecabezas pero necesita que un pedagogo como Ud.le arme el rompecabeza para que el elumno tenga una visión panorámica. Se trata de com--prender cada pieza en el conjunto y no solamente en--tenderla por separado.
Por ejemplo para mi no está claro
1°-- ¿Como puede existir una nube de electrones en el segundo nivel si se afirma que solo pueden haber hasta ese nivel solo 10 electrones ? 1s2, 2s2 2p6
2°-- ¿un quantum de energía que espacio ocupa ? para dibujarlo +-. o sencillamente es independiente del espacio ,o sea, no tiene magnitud espacial,
3°-- pero aparecen fotografías de los orbitales ? o son solo dibujos....
no quiero cansarlo más. solo quiero decirle que estoy inventando lo que sigue. para endender si yo tengo un iman sale del momento magnetico del electron un haz luninoso que y muevo con mi iman- es similara lo que hice hace años .Encendi el televisor.acerque a la pantalla un trozo de iman. de la pantalla salio un haEz verdoso que dirigi a mi gusto con mi iman...
filosofoon g gelgueta34@gmail.com
Felicidades a la página, esta resumido y explicado perfectamente. Realmente me a servido mucho para mis estudios para acceso a la universidad
Sólo dar las gracias al autor =)
Saludos
ola me llamo lizz esta muy chida sta pag creo ke de aora en adelant are miz tareaz aki ke chido zigan azi
hola lo que busco lo encuentro aqui esta pagina para mi es muy buena la recomiendo
Hola! Felicidades por tu blog. Me llamo David. Soy profesor de Fisica, Quimica y Matematicas y me arranqué recientemente a grabar videos en youtube. La acogida está siendo sensacional. Aprovecho para ofrecerte la posibilidad de enlazar a tus seguidores a mi canal de youtube UNICOOS(http://www.youtube.com/davidcpv), de modo que puedan reforzar a nivel practico lo que aprenden contigo a nivel teorico. Del mismo modo yo podría referenciarles a tu blog para que puedan estudiar y resolver dudas más concretas. Espero tus noticias. Un abrazo y buena suerte!
YO TAMBIEN VOY A LA UNI, Y LA PAGINA ESTA MUY BIEN EXPLICADA...PUBLIQUEN MAS!!!.......ANGELA
me gustaria que pusieras ejercicios resueltos a cerca de los numeros cuanticos. es decir cómo se aplican en cada átomo de cualquier elemento
muchas gracias esta pagina contiene lo que necesito para mis trabajos del cole. los voy a agregar en favoritos
esta muy interesante la información. buena pagina.
hola soy magdalena es b¿muy buena pagina ... me interesaria que publicaran el porque en s solo hay una -; en p - - - ; en d - - - - -; f - - - - - - -; y como es k cada una toma valores desde -4 -3 -2 -1 0 1 2 3 4 etc¿el porque en cada letra aumentan dos - -??
muy buena esta publicación,,,, estoy seguro que me ayudara mucho...
la verdad es que me aclaro bastante sobre la representacion de los orbitales s,p muchas gracias por esta pagina tan buena, lastima que no haya de otros temas que necesite
chingen asu madre todos
quimica es para saber como meterle la pinga a tu enamorada ii luego tener su ano rojito
piipokokokkokokokokkokokok
quien quiera tener sexo gratis busqueme en polvos azules dejo tu pene hinchadito ii dejo k me violen hasta k sangre mi vagina condicion tener el pene bien grande llevar penes falsos garantizo un trio x el ano vagina ii boca
caya ksm deja de hablar huevadas
caya ksm deja de hablar huevadas
pude comprendeerr!!!!
de verdad con los apuntes del cuaderno no podia entender nada pero con esta pagina ahora lo se
Muchas graciaassss......
Fighting con la pagina!! n_n
de verdad ayuda demasiado
wuaww qe buena pagina nos sirvio mucho ....facil de entender
holaa la verdad es que noss aclaro bastante sobre la representacion de los orbitales s,p muchas gracias por esta pagina tan buena... mauu ..maira..peqee..maca.Benja :).de sanju..(santa cruz)
ps para mi la quimica no sirbe :p
Me pareció interesante tu entrada, yo venía de esta otra que tampoco está mal pero no me deja las cosas claras.
Qué es la configuración electrónica
Gracias por la información
esta genial la informacion me sirvio de mucho sigue asi
Genial!!! me sirvio para mi parcial!!!
Aun...no entiendo...COMO MIERDA SE CUAL ES EL VALOR DEL ESPIN SI ME DAN UN EJERCICIO QUE SOLO DIGA "3p6" o "3s2" etc. OnO (voy en I° 1/2, no me juzguen T-T)
Sigo sin entender una mierda...
A pesar de no entender es una buena página (Y)
gracias en esta pagiana se encuentra todo para mi tarea
no entendi ni vergas
Hola, queria saber como reconozco que tipo de spin es cuando me dan un problema con +1/2 o -1/2 , o es que los positivos son hacia arriba y los negativos hacia abajo?, o quien tiene prioridad , me refiero a que , quien es primer el positivo o el negativo.
Porfa, responde pronto¡¡¡¡
Mu chas grachitass porr explicarme lo q necesitaba... ahora este tema es mas interesante y me usta maass :D lista para mi examen de validación :P de nuevo, Muchas gracias :D
ni sirve esta mierda solo quiero saber quien lo afirmo y explican otra mierdas.
Wow, la verdad me interesó mucho ^_^
Si hubiera calificación les prometo que les daría 5 estrellas ;)
<3
ME AYUDO MUCHO PARA MI EXAMEN.GRACIAS!
123ñl,
Hola soy bryan dejo mi numero es 941649185 XD manden mensaje XD
XD
i k wa .... me sirbio musho ia k ztoi eztudiando pa laz cemeztralez i ezto me sirbio demaciado i ezop grasias por el tienpo de lerme:D
simplemente GENIAL,me he enterado muchiiiiiisimo mejor que en todo el conjunto de las clases de quimica que he dado!!
gracias
Spephen hawking ya no puede escribir :-)
Me gusto la OVA, l enfoque acerca de sistema novedoso e induce a leer
miles de lecturas,y es la primera vez,que visualizo el submundo atómico en mi cerebro
Muy buena...me aclaro muchas dudas.
Escribí bien fea
no pinchis mames, esta pagina es muy buena. apatir de hoy mandare en lo que se pueda a wikipieda a la mierda
buena
Muy buena pagina👌👌
ok fdj millon help para el examen de mañana, aunque digamos que no lo aprendi muy bien, solo lo necesario para pasar el parcial. tenkiu amiguitos :) ok no ya bye
paskfsgndsdjngfa<jbgdza´ñlskdnfds
wsdgdfgpisangdhsp
spofdgsa
ñasjgidfpogsd
Escribe bien..... :(
Escribe bien..... :(
Escribes con las patas o k?
Estas mamadisimo
Publicar un comentario