La tendencia universal de la materia es la de hallar su mayor estabilidad (contener menor energía). De acuerdo a esta tendencia los átomos se unen para formar agregados de menor estado de energía y por consiguiente de mayor estabilidad, y lo realizan liberando energía.
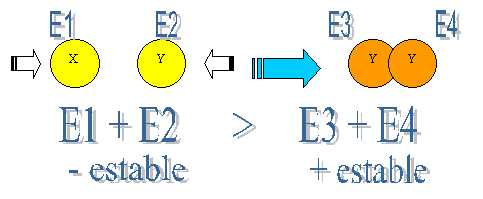
En la formación de un enlace químico participan solo los electrones del último nivel de energía de los átomos, es decir, los llamados electrones de valencia.
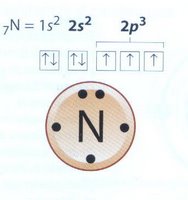

- Cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones de modo que el último nivel de energía de cada átomo contenga 8 electrones y así adquiera la configuración electrónica del gas noble más cercano en la tabla periódica (regla del octeto).
- En el caso de los átomos de los elementos H, Li y Be, cuando establecen enlaces, tienden a completar su último nivel de energía con 2 electrones y alcanzar la configuración electrónica del gas noble helio (He). (Regla del dueto)
- Los elementos metálicos ceden electrones.
- Los elementos no metálicos ganan o comparten electrones.
1.- Enlace iónico: Son fuerzas de atracción electrostática entre iones que se formaron por la transferencia total de electrones originados entre un metal (más electropositivo) y un no metal (electronegativo). Ejemplo: NaCl (cloruro de sodio), CaF2 (fluoruro de calcio).
- Características:
La atracción electrostática se realiza en todas direcciones de tal manera que no existen moléculas si no inmensos cristales con determinadas formas geométricas.
Por lo tanto los compuestos iónicos son sólidos y cristalinos, lo que implica que para romper este enlace se requiere una gran cantidad de energía.
En estado sólido son malos conductores del calor y la electricidad, pero al fundirlos o disolverlos en agua, se logrará la separación de iones y ambos casos conducirán la corriente eléctrica.
Existen reglas empíricas que indican que si: ∆E.N › 1,7 es un enlace iónico.
2.- Enlace covalente: Es un enlace que se origina entre no metales, y se caracteriza por la compartición mutua de uno o más pares de electrones de valencia de tal forma que adquieran la configuración de gas noble. Se forma un compuesto covalente cuando ∆E.N ‹ 1,7. 
Existen distintos tipos de enlaces covalentes:
- Enlace covalente puro (normal): Este enlace se origina entre 2 no metales de un mismo elemento y los electrones compartidos se encuentran en forma simétrica a ambos átomos, y se cumple que ∆E.N = 0. Ejemplo: H2, Br2, Cl2, etc.
Enlace covalente entre átomos de hidrógeno
- Enlace covalente polar: Se origina entre no metales de distintos elementos, se caracteriza por existir una compartición aparente de cargas debido a una diferencia de electronegativida. 0 ‹ ∆E.N ‹ 1,7 Ejemplos: H2O, HCl, CH4, etc.
- Enlace múltiple: Se produce cuando se comparten más de un par electrónico para obtener la configuración del gas noble. Si se comparte 2 pares de electrones se denomina enlace doble, y si se comparten 3 pares de electrones se llama enlace triple. Ejemplo: N2, O2, etc.
Fuerzas intermoleculares
Este tipo de enlaces se caracteriza por que la distancia entre los átomos es más grande, se encuentran las fuerzas de London, Van der Waalls y los puentes de hidrógeno.
- Enlace covalente coordinado o dativo: Es un enlace en el cual uno de los átomos brinda el par de electrones para completar el octeto. Ejemplo: SO2, SO3, H2SO4, etc.
- Enlace metálico: Es un enlace propio de los elementos metálicos que les permite actuar como molécula monoatómica. Los electrones cedidos se encuentran trasladándose continuamente de un átomo a otro formando una densa nube electrónica. A la movilidad de los electrones se le debe la elevada conductividad eléctrica de los metales.
- Enlace puente de hidrógeno: Es un enlace intermolecular (entre moléculas) que se origina entre un átomo de hidrógeno y átomos de alta electronegatividad con pequeño volumen atómico como el fluor, oxígeno o nitrógeno.
A este enlace se debe la disminución anómala de la densidad del agua; que se origina cuando esta se solidifica, se explica con base en la formación de enlaces puentes de hidrógeno entre moléculas de agua en los cristales de hielo, originado un incremento de volumen, de tal manera que la densidad del hielo es menor que la densidad del agua líquida, por lo que el hielo puede flotar. - Fuerzas de Vander Waals: Son fuerzas intermoleculares muy débiles que se efectúan entre moléculas apolares. Debido a estas fuerzas débiles los gases se pueden licuar, es decir pasar al estado líquido.

3 comentarios
muy buen material
hola
pucha justo lo que nesecitaba
me sirve mucho si no solo a mi ademas a muchos mas
chaoooo
gut post.....
Publicar un comentario