Se enunció: “Las propiedades físicas y químicas de los elementos son funciones periódicas de los números atómicos”.
- Es decir los elementos están ordenados en función creciente de sus números atómicos.
- La tabla periódica actual (forma larga) fue diseñada por Werner y es una modificación de la tabla de Mendeleiev.
Descripción: Los elementos se hallan distribuidos:
- En 7 filas denominadas (periodos).
- En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.

PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del elemento. Existen 7 periodos o niveles.
- Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominados Periodos cortos.
- Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
- Los elementos cuyos números atómicos se hallan comprendidos entre el La (Z= 57) y el Lu (Z= 71) se llaman Lantánidos.
- Los elementos con número atómico superior al Ac (Z= 89) se denominan Actínidos.
- Ellos se encuentran separados en 2 filas de la tabla periódica, con el objeto de no extender demasiado la figura.
- Los elementos después del Uranio (Z= 92) se han obtenido en forma artificial del uranio, denominándose a éstos Trans uránicos.
GRUPOS O FAMILIAS: Son agrupaciones verticales, que nos indican que poseen propiedades químicas semejantes, debido a que poseen los mismos electrones de valencia.
En la tabla periódica están ordenados en grupos A y B.
a) GRUPO A:
- Están situados en los extremos de la tabla periódica.
- Nos indican el número de electrones de la última capa y se representan en números romanos.
- Terminan en el subnivel “s” y “p”

a) GRUPO B:
- Están situados en la zona central de la tabla periódica.
- El número de electrones de la última capa, no nos indica el grupo; debido a que la valencia es variable.
- La configuración electrónica termina en el subnivel “d”.
- Los elementos de transición interna, llamados tierras raras: su configuración electrónica termina en “f”.
Tienen 8 subgrupos. El grupo VIII B tiene 3 casilleros. 

Clasificación de los elementos químicos
Los elementos químicos se pueden clasificar en: Metales, no metales, metaloides (anfóteros) y gases nobles.
Metales:
- Son buenos conductores del calor y la electricidad.
- Se oxidan (pierden electrones).
- Se les denomina también reductores.
- Son electropositivos.
- Son sólidos a excepción del mercurio (líquido a temperatura ambiente).
No metales:
- Son malos conductores del calor y la electricidad.
- Se reducen (ganan electrones).
- Se les denomina también oxidantes.
- Son electronegativos.
- La mayoría a temperatura ambiente se encuentran en estado sólido. Como gases están N, O, F, Cl, H y en estado líquido el Br.
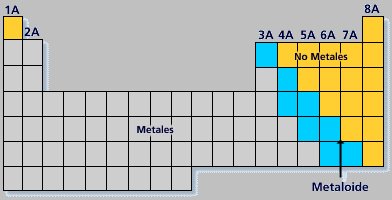
Metaloides o anfóteros:
Son elementos que tienen propiedades metálicas y no metálicas. Ocupan una región diagonal que se observa en la tabla periódica (transición entre metal y no metal); entre ellos podemos encontrar al B, Si, Ge, As, Sb, Te, Po.
Gases nobles:
- Son elementos químicamente estables por tener su última capa 8 e- a excepción del He que tiene 2 y se representan.
n s2 p6 - No se combinan con ningún otro elemento. Sólo a temperaturas exigentes el Xe puede reaccionar.
- Sus moléculas son monoatómicas.
De acuerdo a su configuración electrónica, los elementos químicos se clasifican en: gases nobles, elementos representativos y elementos de transición.
1. Gases nobles: Son los que se ubican en el extremo derecho de la tabla periódica, en el grupo 0, u VIII A (también 18). Los átomos de estos gases, con excepción del helio, tienen 8 electrones de valencia. Esto significa que el último nivel de energía tiene sus orbitales completos (8 e-), distribuidos según la configuración n s2 p6. Donde "n" representa el nivel de energía más externo.
2. Elementos representativos: Se ubican en los grupos A de la tabla periódica. Estos elementos tienen sus electrones de valencia en los orbitales "s" o "p" y sus configuraciones externas van desde n s1 hasta n s2 p5, excluyendo al 1s2 (helio que corresponde a un gas noble).
3. Elementos de transición: Se sitúan en los grupos B de la tabla periódica. Sus átomos presentan configuraciones más complejas; los electrones de valencia se encuentran en los orbitales "d" o "f".




218 comentarios
«Más antiguas ‹Antiguas 201 – 218 de 218 Más recientes› Más nuevas»-
Anónimo
dijo... @
1:57 a. m.

-
-
Anónimo
dijo... @
5:29 p. m.

-
-
Anita
dijo... @
11:25 a. m.

-
-
Anónimo
dijo... @
12:37 p. m.

-
-
Anónimo
dijo... @
4:22 p. m.

-
-
Anónimo
dijo... @
4:23 p. m.

-
-
Anónimo
dijo... @
2:40 p. m.

-
-
Anónimo
dijo... @
1:45 a. m.

-
-
Anónimo
dijo... @
8:04 p. m.

-
-
Anónimo
dijo... @
11:03 a. m.

-
-
Anónimo
dijo... @
10:03 p. m.

-
-
Unknown
dijo... @
11:52 p. m.

-
-
Unknown
dijo... @
11:55 p. m.

-
-
Anónimo
dijo... @
5:57 a. m.

-
-
Anónimo
dijo... @
1:51 p. m.

-
-
Anónimo
dijo... @
1:51 p. m.

-
-
De quimica
dijo... @
5:33 a. m.

-
-
Anónimo
dijo... @
12:03 a. m.

-
«Más antiguas ‹Antiguas 201 – 218 de 218 Más recientes› Más nuevas»jaha gracias al parecer encontre todo mi reporte hecho en esta pagina me facilitaron la vida
malditos inutiles no entendi un coño mamenme el pipi y masturbense malditos hijos de puta
El color café debe ser cortado en forma vertical en el grupo 3A.
Los elementos representativos deben tener una distinción de los de transición.
No conviene colocar muchas formas de clasificación en una misma tabla porque se confunde y complica a los neófitos, y la intención debe ser ayudarlos.
me ayudara a completar la información. muchas gracias.
Bueno al contrario de muchas personas ami la página me a gustado mucho y me a ayudado en lo que buscaba
Bueno al contrario de muchas personas ami la página me a gustado mucho y me a ayudado en lo que buscaba
chingen su madre a la vrg perrs :v
Cuales son Los Subgrupos??
no me ayuda esta informacion no sirve
ES ALGO INCOHERENTE QUE DIGA QUE EL,DESCUBRIO ESO EN 1927 YA QUE EN ESE AÑO EL,YA ESTABA MUERTO.
puto el q lo lea
Increíble
M.R.R
Deja de joder David...anda vos a comprar la plastilina,pensas que todos cagamos plata como vos??....NOOO..baja al mundo Real y fíjate que no es así,no van a hacer todo lo que vos quieras en la vida��
No me ha servido
ne me ha servido
Me gusto mucho el articulo, me encanta como habla de la tabla periódica. Mis enorabuenas
Niko Niko NiIIIIKOOO Niko Niko NIIIIKOOO
Publicar un comentario